题目内容
【题目】电浮选凝聚法是工业上采用的一种污水处理方法;保持污水的pH在5.0~6.0之间,利用电解过程中生成的Fe(OH)3沉淀的吸附性吸附污物而沉积下来,模拟处理装置如下。下列有关说法中错误的是
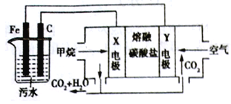
A. X电极是负极,电极反应式为:CH4-8e-+4CO32-=5CO2+2H2O
B. 铁是阳极,先失去电子生成Fe2+
C. 工作时熔融碳酸盐中的CO32-移向Y电极
D. 污水中存在反应4Fe2++10H2O+O2=4Fe(OH)3+8H+
【答案】C
【解析】A、电池是以熔融碳酸盐为电解质,通甲烷电极为负极,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,正极反应为O2+2CO2+4e-=2CO32-,故A正确;B、电解池中Fe为阳极,发生Fe-2e-=Fe2+,故B正确;C、工作时熔融碳酸盐中的CO32-移向X电极,故C错误;D、电解池中Fe为阳极,发生Fe-2e-=Fe2+,污水中存在反应4Fe2++10H2O+O2=4Fe(OH)3+8H+,阴极的电极反应为:2H++2e-=H2↑,故D正确。

【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
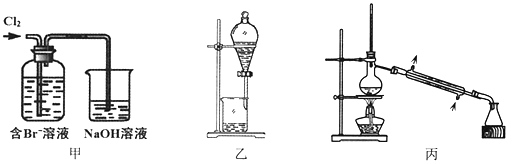
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2