题目内容
【题目】用下列实验装置进行相应实验,能达到实验目的的是
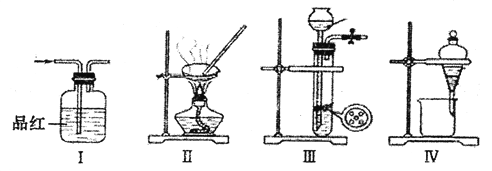
A. 将装置I中通入C12和SO2的混合气体,然后加热褪色后的溶液,据溶液是否变红来证明SO2的是否存在
B. 用装置Ⅱ来蒸发浓缩CuSO4溶液,并通过冷却结晶、过滤的方法获得胆矾晶体
C. 用浓氨水和块状固体NaOH在装置III中作用,来快速制取NH3
D. 用装置IV来分离乙醇萃取碘水后的溶液
【答案】B
【解析】A.氯水的漂白不具有可逆性,另外氯气能够与二氧化硫反应生成硫酸和盐酸,无法通过溶液是否变红来证明SO2的存在,故A错误;B. 硫酸铜溶液水解生成的硫酸不挥发,蒸发浓缩CuSO4溶液,并通过冷却结晶、过滤的方法可以获得胆矾晶体,故B正确;C. 氢氧化钠易溶于水,放在多孔隔板上,不能起到随时停止实验的目的,故C错误;D. 乙醇与水混溶,无法通过装置IV来分离乙醇萃取碘水后的溶液,故D错误;故选B。

【题目】常温下,将一定浓度的HA和HB分别与0.10 mol·L-1的NaOH溶液等体积混合,记录数据如下表,下列说法中正确的是
混合后的溶液 | 加入的酸 | 酸的浓度/(mol·L-1) | 混合后溶液的pH |
① | HA | 0.10 | 8.7 |
② | HB | 0.12 | 2 |
A. HA是强酸,HB是弱酸
B. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+)
C. 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1
D. 升高温度,溶液②中![]() 增大
增大
【题目】完成如下有关硫的化合物的问题。
(1)硫化物与充足的氧气反应会转化为SO2,写出硫化铝在充足的空气中灼烧的反应方程式________________________________________________。
(2)SO2作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质 类别 | 酸性 氧化物 | SO2+H2O |
SO2+CaO=CaSO3 | ||
①______ | ||
S元素 价态 | S为 +4价 | ②______ |
SO2 +2H2S=3S+2H2O | ||
(3)在实验室中利用下图装置(夹持装置略去)测定某铁硫化物(FexSy)的组成。
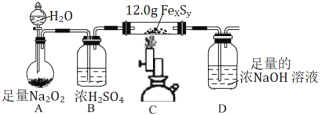
实验步骤:
步骤Ⅰ 如图连接装置,检查装置气密性,装入药品;
步骤Ⅱ 打开A的滴液漏斗活塞与旋塞,并点燃酒精喷灯;
步骤Ⅲ 当硬质玻璃管中固体质量不再改变时,停止加热,继续向烧瓶中滴水一段时间;
步骤Ⅳ 实验结束后,将D中所得溶液加水配制成250 mL溶液;
步骤Ⅴ 取25.00 mL步骤Ⅳ中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66 g。
请回答:
①经测定,步骤Ⅳ所得溶液呈强碱性,其中含有的溶质除NaOH外,还可能有______(填化学式)。
②步骤Ⅲ中,停止加热后还需继续向烧瓶中滴水一段时间,其目的为__________。
③在C、D装置之间不需要防倒吸装置的理由是_____________________________。
④步骤Ⅳ中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有________________。
⑤FexSy的化学式为______________。