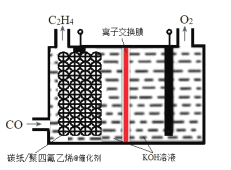
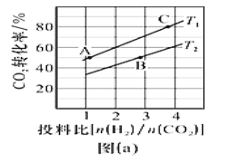
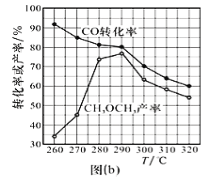
题目内容
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 该反应的ΔS<0、ΔH<0
B. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·S-1
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
【答案】AD
【解析】A、反应前的气体系数之和大于反应后气体系数之和,此反应属于熵减,即△S<0,反应I中产生的N2的物质的量为0.12/2mol=0.06mol,对比反应I和反应III,降低温度,N2的物质的量升高,说明降低温度,平衡向正反应方向移动,即△H<0,故A正确;B、达到平衡N2的物质的量为0.12/2mol=0.06mol,根据化学反应速率的数学表达式,v(N2)=0.06/(1×2)mol/(L·s)=0.03 mol/(L·s),故B错误;C、反应II相当于在I的基础上再通入0.2molNO和0.2molCO,此时假如平衡不移动,c(CO,容器II)= 2c(CO,容器I),增大反应物的浓度,平衡向正反应方向移动,因此有c(CO,容器II)<2c(CO,容器I),故C错误;D、 2NO(g)+2CO(g)![]() N2(g)+2 CO2(g)
N2(g)+2 CO2(g)
起始浓度:0.2 0.2 0 0
变化浓度:0.12 0.12 0.06 0.12
平衡浓度:0.08 0.08 0.06 0.12 根据化学平衡常数的表达式,K= =21,若起始时向I中充入NO、CO、N2、CO2各0.1mol,此时的浓度商Qc=
=21,若起始时向I中充入NO、CO、N2、CO2各0.1mol,此时的浓度商Qc= ![]() =10<21,说明反应向正反应方向进行,V正>V逆,故D正确。
=10<21,说明反应向正反应方向进行,V正>V逆,故D正确。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】H2O2作为绿色氧化剂被应用于废水处理、造纸和化学合成等行业。
(1)已知:H2(g)+![]() O2(g)=H2O(l) ΔH1=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH1=-285.8kJ·mol-1
H2(g)+O2(g)=H2O2(l) ΔH2=-135.8kJ·mol-1
①H2(g)与O2(g)的反应中,在热力学上更有利的产物是__,原因是__。
②常温下,H2O2分解的热化学方程式为__。
(2)我国科学家使用Ag9团簇作催化剂,研究H2O2的合成。各步骤的活化能和反应热,如表所示,利用计算机模拟反应历程如图所示(TS表示过渡态,表示被催化剂吸附的物种)。
Ag9团簇上生成H2O2的活化能Ea和反应热![]()
步骤 | 过渡态 | Ea/kJ |
| |
A | Ag9 | TS1 | 74.1 | +68.7 |
B | H—Ag9 | TS2 | 108.7 | -27.2 |
C | H—Ag9—H+ O2 | TS3 | 78.4 | -75.4 |
D | HOO | TS4 | 124.7 | +31.3 |

①通过降低步骤___(填字母)的能垒(活化能),可以较大幅度提高合成反应的速率。
②反应历程中2到3断裂的化学键为___(填序号)。
A.O2中的氧氧键 B.H2中的氢氢键 C.Ag9OOH中的氧氢键
(3)利用阴阳极同步放电产生H2O2和过硫酸铵[(NH4)2S2O8]的原理如图所示。阳极上放电的离子是___,阴极的电极反应式为___。

(4)常温下,H2O2分解速率方程v=0.0625·c(H2O2)mg·L-1·s-1,c(H2O2)随时间变化如下表:
C(H2O2) (mg | 10000.0 | 8000.0 | 4000.0 | 2000.0 | 1000.0 |
分解时间(s) | 0 | 7 | 23 | 39 | 55 |
①当c(H2O2)=8000.0mg·L-1时,v=__mg·L-1·s-1;
②当c(H2O2)降为5000.0mg·L-1时,分解时间为___s。