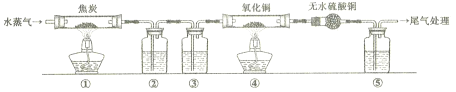
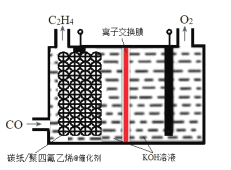
题目内容
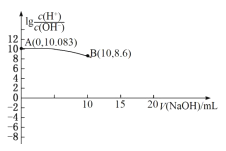
【题目】常温下,用0.010mol/L的NaOH溶液滴定10.00mL 0.010mol/L的酸H2A,滴定过程中加入NaOH溶液的体积(V)与溶液中lg![]() 的关系如图所示(10mL之后的曲线未画出)。下列叙述正确的是( )
的关系如图所示(10mL之后的曲线未画出)。下列叙述正确的是( )
A.H2A![]() H++HA-
H++HA-
B.Ka(HA-)的数量级为10-5
C.滴定过程中,水的电离程度最大的为B点溶液
D.V(NaOH)=15mL时的溶液中:c(Na+)>c(A2-)>c(HA-)
【答案】D
【解析】
用0.010mol/L的NaOH溶液滴定10.00mL 0.010mol/L的酸H2A,依次发生NaOH+H2A=NaHA+H2O、NaHA+NaOH=Na2A+H2O,则当加入10mL的NaOH溶液,溶液中溶质为NaHA。
A.根据A点可知,lg![]() =10.083,因为Kw=[H+][OH-]=10-14,则A点[H+]=10-1.9585mol/L=0.011mol/L,则H2A一级电离为完全电离,H2A=H++HA-,A错误;
=10.083,因为Kw=[H+][OH-]=10-14,则A点[H+]=10-1.9585mol/L=0.011mol/L,则H2A一级电离为完全电离,H2A=H++HA-,A错误;
B.根据A点,[H+]=10-1.9585mol/L=0.011mol/L,因为H2A一级电离为完全电离,则第二步电离出的[A2-]=(0.011-0.01)mol/L=0.001mol/L,则![]() ,Ka(HA-)的数量级为10-3,B错误;
,Ka(HA-)的数量级为10-3,B错误;
C.根据酸碱的数量关系10mL时,完全反应生成NaHA为强酸强碱,20mL时完全中和生成Na2A为强碱弱酸盐,能促进水的电离,故水电离程度最大的点为完全中和时,C错误;
D. V(NaOH)=15mL时的溶液中n(NaHA):n(Na2A)=1:1,又因为Ka(HA-)![]() 10-3mol/L,HA-的电离程度大于A2-的水解程度,故当n(NaHA):n(Na2A)=1:1时溶液显酸性,故c(Na+)>c(A2-)>c(HA-),D正确;
10-3mol/L,HA-的电离程度大于A2-的水解程度,故当n(NaHA):n(Na2A)=1:1时溶液显酸性,故c(Na+)>c(A2-)>c(HA-),D正确;
答案选D。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】水合肼(N2H4H2O)是制备叠氮化钠(NaN3)的原料,而叠氮化钠又是汽车安全气囊最理想的气体发生剂的原料。如图是工业水合肼法制备叠氮化钠的工艺流程。

查阅资料:①水合肼有毒且不稳定,具有强还原性和强碱性;
②有关物质的物理性质如下表:
物质 | 甲醇 | 水合肼 | 亚硝酸甲酯 | 叠氮化钠 |
熔点(℃) | -97 | -40 | -17 | 275(410℃:易分解) |
沸点(℃) | 64.7 | 118.5 | -12 | — |
回答下列问题:
Ⅰ.合成水合肼。实验室水合肼合成水合肼装置如图所示,NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
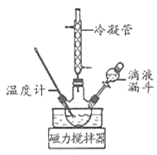
(1)实验中通过滴液漏斗向三颈瓶中缓慢滴加NaClO溶液的原因是_____;N2H4 的结构式为_____,制取N2H4H2O的离子方程式为_________。
II.制备叠氮化钠。实验室可利用如图所示的装置及药品制备叠氮化钠。
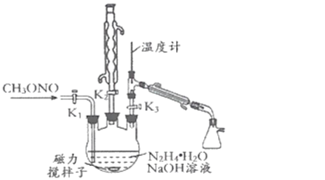
(2)①根据实验发现温度在20℃左右反应的转化率最高,但是该反应属于放热反应,因此 可釆取的措施是_____;流程中A溶液蒸馏前,图中装置中开关K1、K2、K3的合理 操作顺序是______。
②写出该方法制备叠氮化钠的化学方程式:_____。
(3)流程中由B溶液获得叠氮化钠产品的实验步骤为_____,减压过滤,晶体用乙醇洗涤23次后,再_____干燥。
(4)化工生产中,多余的叠氮化钠常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5mol L-1的NaClO溶液_____mL