题目内容
【题目】前20号元素M、N、R、Q、Z的原子序数依次递增,M与Z、N与Q分别同主族,M、N形成的常见化合物有M2N、M2N2,由该5种元素组成的某结晶化合物X常用作净水剂。下列叙述错误的是( )
A.化合物X中含有离子键和共价键
B.简单离子半径由大到小的顺序为ZRQN
C.N、Q分别与Z形成化合物的水溶液均呈碱性
D.R、Q、Z的最高价氧化物的水化物间能相互反应
【答案】B
【解析】
由5种元素组成的某结晶化合物X常用作净水剂,X可能为明矾KAl(SO4)2![]() 12H2O,K与H、O与S同主族,H与O能形成H2O、H2O2,符合题意,故M、N、R、Q、Z分别为H、O、Al、S、K。
12H2O,K与H、O与S同主族,H与O能形成H2O、H2O2,符合题意,故M、N、R、Q、Z分别为H、O、Al、S、K。
A.综上分析,X为KAl(SO4)2![]() 12H2O,分子中既含钾离子、铝离子与硫酸根离子的离子键又含硫原子与氧原子、氢原子与氧原子的共价键,A正确;
12H2O,分子中既含钾离子、铝离子与硫酸根离子的离子键又含硫原子与氧原子、氢原子与氧原子的共价键,A正确;
B.离子电子层数越多半径越大,层数相同时,核电荷数越大半径越小,则N、R、Q、Z对应的离子半径由小到大的是S2->K+>O2->Al3+,应为QZNR,B错误;
C.N与Z形成化合物K2O、K2O2与水反应生成KOH,Q与Z形成的化合物为K2S,易水解使溶液均呈碱性,C正确;
D. R、Q、Z的最高价氧化物的水化物分别为氢氧化铝、硫酸、氢氧化钾,氢氧化铝具有两性,能与强酸、强碱反应,故硫酸与氢氧化钾均能和氢氧化铝反应,D正确;
答案选B。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】H2O2作为绿色氧化剂被应用于废水处理、造纸和化学合成等行业。
(1)已知:H2(g)+![]() O2(g)=H2O(l) ΔH1=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH1=-285.8kJ·mol-1
H2(g)+O2(g)=H2O2(l) ΔH2=-135.8kJ·mol-1
①H2(g)与O2(g)的反应中,在热力学上更有利的产物是__,原因是__。
②常温下,H2O2分解的热化学方程式为__。
(2)我国科学家使用Ag9团簇作催化剂,研究H2O2的合成。各步骤的活化能和反应热,如表所示,利用计算机模拟反应历程如图所示(TS表示过渡态,表示被催化剂吸附的物种)。
Ag9团簇上生成H2O2的活化能Ea和反应热![]()
步骤 | 过渡态 | Ea/kJ |
| |
A | Ag9 | TS1 | 74.1 | +68.7 |
B | H—Ag9 | TS2 | 108.7 | -27.2 |
C | H—Ag9—H+ O2 | TS3 | 78.4 | -75.4 |
D | HOO | TS4 | 124.7 | +31.3 |

①通过降低步骤___(填字母)的能垒(活化能),可以较大幅度提高合成反应的速率。
②反应历程中2到3断裂的化学键为___(填序号)。
A.O2中的氧氧键 B.H2中的氢氢键 C.Ag9OOH中的氧氢键
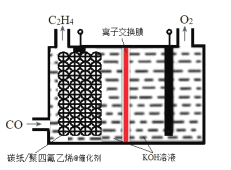
(3)利用阴阳极同步放电产生H2O2和过硫酸铵[(NH4)2S2O8]的原理如图所示。阳极上放电的离子是___,阴极的电极反应式为___。

(4)常温下,H2O2分解速率方程v=0.0625·c(H2O2)mg·L-1·s-1,c(H2O2)随时间变化如下表:
C(H2O2) (mg | 10000.0 | 8000.0 | 4000.0 | 2000.0 | 1000.0 |
分解时间(s) | 0 | 7 | 23 | 39 | 55 |
①当c(H2O2)=8000.0mg·L-1时,v=__mg·L-1·s-1;
②当c(H2O2)降为5000.0mg·L-1时,分解时间为___s。