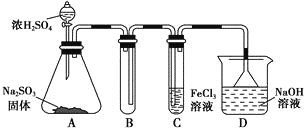
题目内容
【题目】已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=8.0×10-38,Kb(NH3·H2O)=1.8×10-5,下列叙述中不正确的是
A.25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀
B.25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂
C.25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强
D.25℃时,![]() +H2O
+H2O![]() NH3·H2O+H+的平衡常数为5.6×10-10
NH3·H2O+H+的平衡常数为5.6×10-10
【答案】C
【解析】
A、假设镁离子和铁离子的浓度为0.01mol/L,依据溶度积可以计算出形成两种沉淀时需要的氢氧根离子浓度,形成氢氧化铁所需要的氢氧根离子浓度小,正确,不选A;
B、氯化镁溶液中有少量氯化铁,可以加入氧化镁进行除杂,利用了氧化镁消耗氯化铁水解生成的氢离子,促进氯化铁水解生成氢氧化铁,同时氧化镁转化成氯化镁,不引入新的杂质,正确,不选B;
C、加大量水稀释氨水,促进氨水的电离平衡正向移动,电离程度增大,但由于加入大量水,导致溶液体积变大,铵根离子浓度和氢氧根离子浓度降低,溶液导电能力减弱,错误,选C;
D、常温下,铵根离子水解平衡常数和氨水的电离平衡常数的乘积等于水的离子积,正确,不选D。

【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____________________(填字母)。
A.c(H+) B.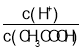 C.c(H+)c(OH﹣) D.
C.c(H+)c(OH﹣) D.![]() E.
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:______________________。
(4)25℃时,将a mol/L的醋酸与等浓度的氢氧化钠等体积混合,反应后溶液中的离子浓度由大到小关系是______________________________。