题目内容
将盛有12mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是( )
①1.2mL ②2.4mL ③3.6mL ④4mL
①1.2mL ②2.4mL ③3.6mL ④4mL
| A.①② | B.①③ | C.②④ | D.①④ |
D
试题分析:2ml的无色气体,不是O2就是NO (NO2为棕红色 也不可能是O2和NO混合气,混合气反应产生NO2)。
(1)剩余O2,NO2和O2反应,O2过量2ml,剩下10ml为O2和NO2的混合气,反应4NO2+O2+2H2O=4HNO3,NO2/O2=4/1,
参加反应的O2为2ml,O2共4ml。
(2)剩余2ml NO,O2完全反应,设O2体积为Xml,则NO2体积为(12-X) ml,Xml的O2可以使4Xml的NO2全部生成硝酸不产生NO,剩下(12-5X) ml的NO2在没有O2的情况下 3NO2+H2O=2HNO3+NO,产生(12-5X)/3ml的NO,(12-5X)/3=2,
X=1.2ml。故选D。
点评:本题考查的是二氧化氮和一氧化氮的性质及其计算,学生要熟练书写出发生的化学方程式,再结合假设法,进行计算,解答本题。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
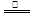 3Cu(NO3)2 + 2NO↑+ 4H2O
3Cu(NO3)2 + 2NO↑+ 4H2O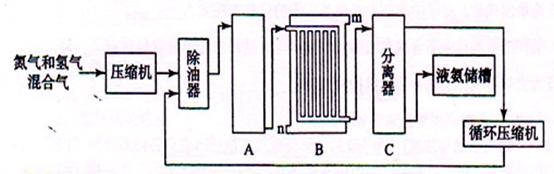
 CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 
 N2O3(g),其平衡常数表达式为K=________。
N2O3(g),其平衡常数表达式为K=________。