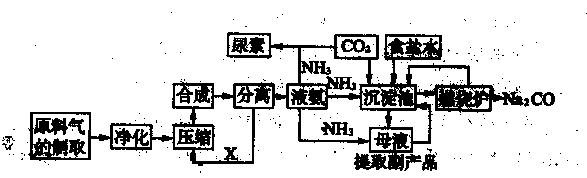
题目内容
硝酸铜是制备Cu—Zn—Al系催化剂的重要原料。现有三种制取硝酸铜的实验方案可供选用:①铜与稀硝酸反应制取:3Cu + 8HNO3(稀)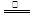 3Cu(NO3)2 + 2NO↑+ 4H2O
3Cu(NO3)2 + 2NO↑+ 4H2O
②铜与浓硝酸反应制取:Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑+ 2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:2Cu + O2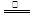 2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O 下列有关说法正确的是( )
2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O 下列有关说法正确的是( )
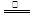 3Cu(NO3)2 + 2NO↑+ 4H2O
3Cu(NO3)2 + 2NO↑+ 4H2O②铜与浓硝酸反应制取:Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑+ 2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:2Cu + O2
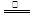 2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O 下列有关说法正确的是( )
2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O 下列有关说法正确的是( )| A.制取等量的硝酸铜,需硝酸的量②最少 |
| B.制取等量的硝酸铜,②产生的有毒气体比①少 |
| C.三种方案中,第③方案最经济环保 |
| D.三种方案的反应都可以在铁质容器中进行 |
C
试题分析:A、根据制取硝酸铜的化学反应方程式可以判断:制备1molCu(NO3)2,需要HNO3的物质的量,①中需要
 HNO3;②中需要4molHNO3;③中需要2molHNO3,所以需要硝酸的量②>①>③,③最少故A错误;B、由制取硝酸铜三种设计方案的化学反应方程式可以判断:制备1molCu(NO3)2,①中放出
HNO3;②中需要4molHNO3;③中需要2molHNO3,所以需要硝酸的量②>①>③,③最少故A错误;B、由制取硝酸铜三种设计方案的化学反应方程式可以判断:制备1molCu(NO3)2,①中放出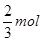 NO气体,②中放出2molNO2气体,③中没有气体放出,制取相同量的硝酸铜①产生的有毒气体比②少,故B错误;C、由制取硝酸铜三种设计方案的化学反应方程式可以判断:制备1molCu(NO3)2,①中需要
NO气体,②中放出2molNO2气体,③中没有气体放出,制取相同量的硝酸铜①产生的有毒气体比②少,故B错误;C、由制取硝酸铜三种设计方案的化学反应方程式可以判断:制备1molCu(NO3)2,①中需要 HNO3,放出
HNO3,放出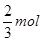 NO气体,硝酸利用率为
NO气体,硝酸利用率为 ;②中需要4molHNO3,放出 2molNO2气体,硝酸利用率为
;②中需要4molHNO3,放出 2molNO2气体,硝酸利用率为 ;③中没有气体放出,HNO3的利用率为100%,三种方案中硝酸的利用率③>①>②,故C正确;D、稀硝酸与铁发生反应,且生成的 Cu(NO3)2 与铁反应,故不可以在铁制容器中进行,故D错误,答案选C。
;③中没有气体放出,HNO3的利用率为100%,三种方案中硝酸的利用率③>①>②,故C正确;D、稀硝酸与铁发生反应,且生成的 Cu(NO3)2 与铁反应,故不可以在铁制容器中进行,故D错误,答案选C。点评:该题是中等难度的试题,也是高考中的常见题型,试题贴近高考,在注重对学生思维能力培养和训练的同时,还注重对学生环境保护意识和能源节约意识的培养,有利于培养学生的逻辑推理能力和发散思维能力。

练习册系列答案
相关题目
 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大
2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大 4NO+6H2O
4NO+6H2O