题目内容
实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl====NaCl+N2↑+2H2O.关于该反应的下列说法正确的是
| A.N2既是氧化剂,又是还原剂 |
| B.每生成lmolN2转移的电子的物质的量为6mol |
| C.NH4Cl中的氮元素被还原 |
| D.NaNO2是氧化剂 |
D
试题分析:A、反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,NaNO2中N的化合价从+3价降为0价,NH4C1中的氮元素化合价从-3价升为0价,氮气既是氧化产物又是还原产物,故A错误;
B、反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,化合价升高值=化合价降低值=转移电子数=3,即每生成1molN2时,转移电子的物质的量为3mol,故B错误;
C、NH4C1中的氮元素化合价从-3价升为0价,所以NH4C1中的氮元素被氧化,故C错误;
D、反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,NaNO2中N的化合价从+3价降为0价,NaNO2是氧化剂,故D正确。
故选D。
点评:氧化还原反应中氧化剂、还原剂的概念以及电子转移知识是重点,考查学生对教材的熟悉程度,难度不大。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
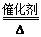 4NO+6H2O
4NO+6H2O