题目内容
4. 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体.如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为先逐渐增大,后逐渐减小;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为2S2-+SO32-+6H+=3S↓+3H2O;此时在B、C两装置中可能观察到的现象为B中品红溶液褪色,C中无明显变化.(或答“B中无明显变化,C中产生黑色沉淀”).
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X).为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),你认为合理的方案是乙(填“甲”或“乙”),请说明另一方案不合理的原 因甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO42-,不能判定是否生成SO42-.
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式4Na2SO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2S+3Na2SO4.
分析 (1)Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3;
(2)加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,说明加热分解后的固体中含硫化钠和未分解的亚硫酸钠;
(3)加快物质溶解可以搅拌加热等措施,依据题干信息分析判断分解后的固体含有硫酸钠,X为SO42-,依据硫酸根离子的检验方法分析判断;亚硫酸根离子遇硝酸会被氧化为硫酸根;
(4)Na2SO3固体加热到600℃以上分解生成硫化钠和硫酸钠.
解答 解:(1)Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3,向此固体中滴加HCl后,一方面是Na2SO3固体溶于水,这将导致溶液中SO32-浓度增大;另一方面是HCl与SO32-反应,这将导致SO32-浓度减小生成亚硫酸氢根离子浓度增大;加入HCl到一定程度时,SO32-已完全转化为HSO3-,此时前者作用消失,完全是后者起作用,HSO3-浓度先增大后将逐渐减小,直至最后下降到接近于零,
故答案为:先逐渐增大,后逐渐减小;
(2)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀为硫,且有大量气泡产生说明为二氧化硫,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O;生成二氧化硫的反应为SO32-+2H+=SO2↑+H2O,此时在B、C两装置中可能观察到得现象为二氧化硫具有漂白作用使品红褪色,生成的气体不是硫化氢通过硫酸铜无现象,B中无明显变化,C中产生黑色沉淀;
故答案为:2S2-+SO32-+6H+=3S↓+3H2O;B中品红溶液褪色,C中无明显变化.(或答“B中无明显变化,C中产生黑色沉淀”);
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X).通过实验分析判断,离子为硫酸根离子(SO42-),确定分解产物为硫化钠和硫酸钠,为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可以用玻璃棒搅拌或加热,检验硫酸根离子是加入盐酸,无变化,再加入氯化钡生成白色沉淀证明是硫酸根离子,甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO42-,不能判定是否生成SO42-,
故答案为:乙; 甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO42-,不能判定是否生成SO42-;
(5)依据上述分析判断,亚硫酸钠加热到600℃以上分解生成硫化钠和硫酸钠,反应的化学方程式为4Na2SO3Na2S+3Na2SO4,
故答案为:4Na2SO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2S+3Na2SO4.
点评 本题考查了物质性质验证的实验设计和实验分析判断,主要考查硫及其化合物性质的应用,侧重于基础知识的综合应用的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 标准状况下,22.4L H2O含有的分子数等于0.1NA | |
| B. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 常温常压下,1 mol 甲烷分子中所含质子数为10NA | |
| D. | 标准状况下,22.4L乙醇的分子数为NA |
| A. | 淀粉、脂肪和蛋白质都是人体必需的高分子化合物 | |
| B. | 汽油、柴油和植物油都是碳氢化合物 | |
| C. | 高压聚乙烯是无毒高分子化合物,可用作食品包装袋等薄膜制品 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
| A. | 氧化性:Cl2>Fe3+>Br2>I2 | |
| B. | ②发生反应Fe2++Cl2=Fe3++2Cl- | |
| C. | 实验中只有氯气发生氧化反应 | |
| D. | 实验②发生的反应中,有一个是非氧化还原反应 |
| A. | 7.8 g Na2O2中含有的阴离子数目为0.2NA | |
| B. | 足量Zn与一定量的浓硫酸反应,产生22.4L(标准状况)气体时转移的电子数一定为2NA | |
| C. | 1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |
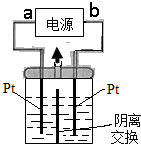 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅.(已知:3I2+6OH-═IO3-+5I-+3H2O,IO3-离子无色);下列说法不正确的是( )
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅.(已知:3I2+6OH-═IO3-+5I-+3H2O,IO3-离子无色);下列说法不正确的是( )| A. | 右侧发生的电极反应式:2H2O+2e-═H2↑+2OH- | |
| B. | a为电源正极 | |
| C. | 电解结束时,右侧溶液中没有IO3- | |
| D. | 用阴离子交换膜,电解槽内发生的总化学方程式为:KI+3H2O$\frac{\underline{\;电解\;}}{\;}$ KIO3+3H2↑ |
| A. | 等物质的量的N2和CO所含分子数均为NA | |
| B. | 1.7 g H2O2中含有的电子数为0.9NA | |
| C. | 标准状况下,22.4L空气含有NA个单质分子 | |
| D. | 1mol•L-1NaCl溶液含有NA个Na+ |
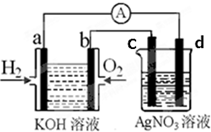 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极)
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极)