题目内容
15.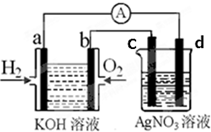 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极)
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极)(1)电极a为负极(填“正”或“负”),溶液中OH-移向a极(填a或b);
(2)电极b处所发生的电极反应方程式为O2+2H2O+4e-=4OH-;
(3)随着反应的进行,氢氧燃料电池内部溶液的PH将减小(填“增大”或“减小”);
(4)c极为阳(填“阴”或“阳”)极,电极反应式为4OH--4e-=2H2O+O2↑;
(5)如图装置中盛有100mL0.1mol•L-1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时右图装置中溶液的c(H+)=0.1mol/L.(溶液体积变化忽略不计)
(6)氢氧燃料电池的优点无污染.
分析 氢氧燃料电池工作时,通入氢气的电极为负极即a极,发生氧化反应,在碱性溶液中,电极方程式为H2-2e-+2OH-=2H2O,通入氧气的电极为正极即b极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,总反应式为2H2+O2=2H2O,电解硝酸银溶液,与a极相连的d为阴极发生4Ag++4e-=4Ag,与b极相连的c为阳极发生4OH--4e-=2H2O+O2↑,总反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4HNO3+O2↑+4Ag,据此分析解读.
解答 解:氢氧燃料电池工作时,通入氢气的电极为负极即a极,发生氧化反应,在碱性溶液中,电极方程式为H2-2e-+2OH-=2H2O,通入氧气的电极为正极即b极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,总反应式为2H2+O2=2H2O,电解硝酸银溶液,与a极相连的d为阴极发生4Ag++4e-=4Ag,与b极相连的c为阳极发生4OH--4e-=2H2O+O2↑,总反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4HNO3+O2↑+4Ag,
(1)根据以上分析,电极a为负极,溶液中OH-移向a极,故答案为:负;a;
(2)电极b处所发生的电极反应方程式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(3)因为总反应式为2H2+O2=2H2O,则随着反应的进行,碱性减弱,所以氢氧燃料电池内部溶液的PH将减小,故答案为:减小;
(4)c极为阳极,电极反应式为4OH--4e-=2H2O+O2↑,故答案为:阳;4OH--4e-=2H2O+O2↑;
(5)电解硝酸银溶液,阴极发生4Ag++4e-=4Ag,阳极发生4OH--4e-=2H2O+O2↑,
总反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4HNO3+O2↑+4Ag,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,
n(H2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,由电极方程式H2-2e-+2OH-=2H2O可知转移电子0.01mol,由电解AgNO3的总反应式可知,转移4mol电子,生成4mol硝酸,因此转移0.01mol电子,产生硝酸0.01mol,c(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,故答案为:0.1mol/L;
(6)氢氧燃料电池的优点无污染,故答案为:无污染.
点评 本题考查电化学知识,为高考常见题型,侧重于考查学生综合运用化学知识的能力和分析问题的能力,题目难度中等.

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案| A. | 12g金刚中含共价键数目为2NA | |
| B. | 密闭容器中2molNO与1molO2充分反应,生成物的分子数为2NA | |
| C. | 常温下,10L,PH=13的Ba(OH)2溶液含OH-的数目为NA | |
| D. | 过氧化钠与水反应时,生成1molO2时转移电子数为2NA |

| A. | 装置Ⅰ:可以用来验证碳的非金属性比硅强 | |
| B. | 装置Ⅱ:橡皮管的作用是使水顺利流下 | |
| C. | 装置Ⅲ:不能检查该装置的气密性 | |
| D. | 装置Ⅳ:先从①口进气收集满二氧化碳,再从②口进气,可收集NO气体 |

 的名称是2-甲基-2-丁烯
的名称是2-甲基-2-丁烯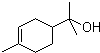 的分子式是C10H18O
的分子式是C10H18O 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题: