题目内容
【题目】如图所示,将大烧杯丙扣在甲乙两个小烧杯(口向上)上。向两个小烧杯中分别装入如下表所列的试剂进行实验。实验现象与预测现象不同的是
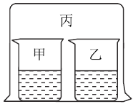
甲中试剂 | 乙中试剂 | 预测现象 | |
A | 浓盐酸 | 硝酸银溶液 | 乙中产生白色沉淀 |
B | 浓氨水 | 硫酸铁溶液 | 乙中产生红褐色沉淀 |
C | 浓盐酸 | 浓氨水 | 丙中产生白色烟雾 |
D | 氯化铝溶液 | 浓氨水并加入 固体氢氧化钠 | 甲中先产生白色沉淀,后又沉淀消失 |
A. AB. BC. CD. D
【答案】D
【解析】
A.甲烧杯中浓盐酸挥发出HCl,HCl和乙烧杯中的硝酸银溶液反应生成氯化银白色沉淀,故A正确;
B. 甲烧杯中浓氨水挥发出NH3,NH3和乙烧杯中的硫酸铁溶液反应生成氢氧化铁红褐色沉淀,故B正确;
C. 甲烧杯中浓盐酸挥发出HCl,乙烧杯中浓氨水挥发出NH3,HCl和NH3反应生成氯化铵,丙中产生白色烟雾,故C正确;
D. 乙烧杯中浓氨水加入固体氢氧化钠产生NH3,NH3和甲烧杯中的氯化铝溶液反应生成氢氧化铝白色沉淀,但氢氧化铝不溶于氨水,故D错误。
故答案选D。

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol。某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol。某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6 mol/L
③平衡时,反应混合物的总能量减小20 kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08 mol·L-1
A. ①②④⑤ B. ②⑥ C. ②③④⑥ D. ②④⑥