题目内容
【题目】有关电化学知识的描述正确的是

A. Cu+H2SO4= CuSO4+H2↑这个反应可设计成原电池。
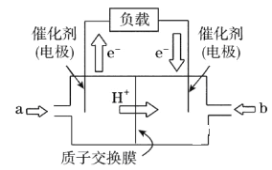
B. 利用Cu+2FeCl3=CuCl2+2FeCl2,可设计如图所示原电池装置,盐桥内K+向FeCl3溶液移动。
C. 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,铁作负极,铜作正极,其负极反应式为Fe-2e-=Fe2+。
D. 由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-=Mg(OH)2。
【答案】B
【解析】
A.构成原电池内界条件是自发的发生氧化还原反应;
B.盐桥中的阳离子移向正极,阴离子移向负极;
C.Fe遇到浓硝酸会钝化;
D.原电池中失电子的一极为负极。
A.构成原电池内界条件是自发的发生氧化还原反应,Cu+H2SO4= CuSO4+H2↑为非自发进行的氧化还原反应,故不能设计成原电池,故A错误;
B.该原电池中,铜做负极,碳棒做正极,所以盐桥中的K+向FeCl3溶液移动,所以B选项是正确的;
C.Fe遇到浓硝酸会钝化,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,必是Cu作负极,Fe作正极,其负极反应式为Cu-2e-═Cu2+,故C错误;
D.原电池中失电子的一极为负极,由Al、Mg与氢氧化钠溶液组成的原电池中,Al在负极失电子生成偏铝酸根离子,Mg作正极,故D错误。
所以B选项是正确的。

【题目】如图所示,将大烧杯丙扣在甲乙两个小烧杯(口向上)上。向两个小烧杯中分别装入如下表所列的试剂进行实验。实验现象与预测现象不同的是

甲中试剂 | 乙中试剂 | 预测现象 | |
A | 浓盐酸 | 硝酸银溶液 | 乙中产生白色沉淀 |
B | 浓氨水 | 硫酸铁溶液 | 乙中产生红褐色沉淀 |
C | 浓盐酸 | 浓氨水 | 丙中产生白色烟雾 |
D | 氯化铝溶液 | 浓氨水并加入 固体氢氧化钠 | 甲中先产生白色沉淀,后又沉淀消失 |
A. AB. BC. CD. D