题目内容
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol。某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol。某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6 mol/L
③平衡时,反应混合物的总能量减小20 kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08 mol·L-1
A. ①②④⑤ B. ②⑥ C. ②③④⑥ D. ②④⑥
【答案】B
【解析】
因为正反应为放热反应,升高温度平衡常数减小,①错;根据表格数据可知,反应转化生成的CH3OCH3、H2O浓度均为1.24 mol·L-1,此时CH3OH的浓度为0.8 mol·L-1,根据Qc=![]() ,将各物质的浓度代入可得,Qc=2.4<400,所以此时没有达到平衡,此时反应向正反应方向进行,⑤错;由化学平衡常数计算可知平衡时c(CH3OCH3)=1.6 mol/L,②对;生成CH3OCH3的物质的量为1.6 mol,根据方程式可知生成1.6 mol×25 kJ·mol-1=40 kJ,③错;平衡时,再加入与起始等量的CH3OH,相当于增大压强,平衡不移动,CH3OH的转化率不变,④错;根据②可知,达到平衡时CH3OH的浓度为0.8 mol·L-1-0.72 mol·L-1=0.08 mol·L-1,⑥对。
,将各物质的浓度代入可得,Qc=2.4<400,所以此时没有达到平衡,此时反应向正反应方向进行,⑤错;由化学平衡常数计算可知平衡时c(CH3OCH3)=1.6 mol/L,②对;生成CH3OCH3的物质的量为1.6 mol,根据方程式可知生成1.6 mol×25 kJ·mol-1=40 kJ,③错;平衡时,再加入与起始等量的CH3OH,相当于增大压强,平衡不移动,CH3OH的转化率不变,④错;根据②可知,达到平衡时CH3OH的浓度为0.8 mol·L-1-0.72 mol·L-1=0.08 mol·L-1,⑥对。

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】如图所示,将大烧杯丙扣在甲乙两个小烧杯(口向上)上。向两个小烧杯中分别装入如下表所列的试剂进行实验。实验现象与预测现象不同的是
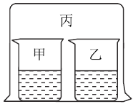
甲中试剂 | 乙中试剂 | 预测现象 | |
A | 浓盐酸 | 硝酸银溶液 | 乙中产生白色沉淀 |
B | 浓氨水 | 硫酸铁溶液 | 乙中产生红褐色沉淀 |
C | 浓盐酸 | 浓氨水 | 丙中产生白色烟雾 |
D | 氯化铝溶液 | 浓氨水并加入 固体氢氧化钠 | 甲中先产生白色沉淀,后又沉淀消失 |
A. AB. BC. CD. D
【题目】已知,反应①:I2(aq)+I-(aq)![]() I3-(aq) △H1;反应②: I3-(aq)
I3-(aq) △H1;反应②: I3-(aq) ![]() I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K1 | 1100 | 841 | 680 | 533 | 409 |
请回答:
(1)若反应②的化学平衡常数为K2,在相同温度下,K1·K2=____________。
(2)上述反应①的△H1_______0(填“>”、“=”、“<”);若升高温度,则I2的溶解速率会______(填“加快”、“减慢”或“不变”)。
(3)能判断反应①已达到平衡的依据是_______________
A.容器中的压强不再改变 B.溶液的颜色不再改变
C.I-浓度不再变化 D.正逆反应速率均为0
(4)某温度下,反应①的化学平衡常数为800。在该温度下,向甲、乙、丙三个容器中分别加入I2和I-,这两种物质的起始浓度如下:
起始浓度(mol/L) | 甲 | 乙 | 丙 |
c(I2) | 0.1 | 0.2 | 0.2 |
c(I-) | 0.2 | 0.1 | 0.2 |
反应速率最快的是_____________(填“甲”、“乙”或“丙”),平衡时I2的转化率最大的是__________(填“甲”、“乙”或“丙”)。