题目内容
【题目】某学习小组在实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图:
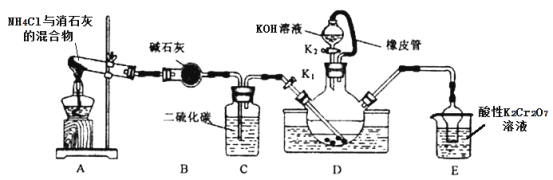
已知:①CS2不溶于水,比水重;NH3不溶于CS2;②三颈烧瓶内盛放有CS2、水和催化剂。
实验步骤如下:
(1)制备NH4SCN溶液:CS2+3NH3![]() NH4SCN+ NH4HS(该反应比较缓慢)
NH4SCN+ NH4HS(该反应比较缓慢)
①实验前,经检验装置的气密性良好。三颈烧瓶的下层CS2液体必须浸没导气管口,目的是_____。
②实验开始时打开K1,加热装置A、D,使A中产生的气体缓缓通入D中,至CS2消失。
则:装置A中反应的化学方程式是_____;装置C的作用是______。
(2)制备KSCN溶液:熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS= H2S↑ + 3NH3↑),打开K2,再缓缓滴加入适量的KOH溶液,发生反应:NH4SCN + KOH= KSCN + NH3↑ +H2O。
小组讨论后认为:实验中滴加入相同浓度的K2CO3溶液比KOH溶液更好,理由是_____。
(3)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶______,干燥,得到硫氰化钾晶体。
(4)测定晶体中KSCN的含量:称取10.0g样品配成1000mL溶液量取20.00mL于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液做指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN- + Ag+= AgSCN↓(白色)。则判断达到终点时的方法是____。
②晶体中KSCN的质量分数为____。
【答案】使反应物充分接触,防止发生倒吸 2NH4Cl+ Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O 观察气泡流速,以便控制加热温度 K2CO3溶液碱性弱于KOH,且与NH4SCN反应产生更多气体(或K2CO3 + 2NH4SCN
CaCl2+ 2NH3↑+ 2H2O 观察气泡流速,以便控制加热温度 K2CO3溶液碱性弱于KOH,且与NH4SCN反应产生更多气体(或K2CO3 + 2NH4SCN![]() 2KSCN + 2NH3↑ + CO2↑+ H2O),有利于溶液中残留的H2S逸出 过滤,洗涤 滴入一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复 97.0%
2KSCN + 2NH3↑ + CO2↑+ H2O),有利于溶液中残留的H2S逸出 过滤,洗涤 滴入一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复 97.0%
【解析】
(1)①导气管口在液面下,可以使反应物充分接触,据此分析;
②实验室用氯化铵与氢氧化钙来制备氨气;反应为气体参加的装置,装置C中没有化学反应,可观察气泡速率,据此解答;
(2)步骤一中得到了NH4SCN,NH4SCN与KOH反应的方程式已知,K2CO3溶液碱性弱于KOH,且条件可以优化,从该角度考虑作答;
(3)依据实验室制备晶体的基本操作步骤解答。
(1)①导气管口在液面下,可以使反应物充分接触,防止发生倒吸,故答案为:使反应物充分接触,防止发生倒吸;
②实验室用氯化铵与氢氧化钙来制备氨气,其化学方程式为:2NH4Cl+ Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O,装置C是为了观察气泡的速率、控制A装置的加热温度,来控制气体的产生速度。故答案为:2NH4Cl+ Ca(OH)2
CaCl2+ 2NH3↑+ 2H2O,装置C是为了观察气泡的速率、控制A装置的加热温度,来控制气体的产生速度。故答案为:2NH4Cl+ Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O;观察气泡流速,以便控制加热温度
CaCl2+ 2NH3↑+ 2H2O;观察气泡流速,以便控制加热温度
(2)K2CO3溶液碱性弱于KOH,且与NH4SCN反应产生更多气体(或K2CO3 + 2NH4SCN![]() 2KSCN + 2NH3↑ + CO2↑+ H2O),有利于溶液中残留的H2S逸出,故答案为:K2CO3溶液碱性弱于KOH,且与NH4SCN反应产生更多气体(或K2CO3 + 2NH4SCN
2KSCN + 2NH3↑ + CO2↑+ H2O),有利于溶液中残留的H2S逸出,故答案为:K2CO3溶液碱性弱于KOH,且与NH4SCN反应产生更多气体(或K2CO3 + 2NH4SCN![]() 2KSCN + 2NH3↑ + CO2↑+ H2O),有利于溶液中残留的H2S逸出;
2KSCN + 2NH3↑ + CO2↑+ H2O),有利于溶液中残留的H2S逸出;
(3)实验室制备晶体的操作:减压蒸发浓缩,冷却结晶,过滤、洗涤,干燥,故答案为:过滤,洗涤;
(4)①Fe3+与SCN-发生络合反应,显红色,因此当最后一滴AgNO3溶液滴入时,SCN-反应完,红色褪去,并且半分钟内颜色不恢复;
②样品溶解后配成1000mL,只取了20.00mL溶液,相当于稀释了50倍,且KSCN的物质的量为:n(KSCN)=n(AgNO3)=0.1000mol/L×20.00×10-3L=0.002 mol,又KSCN的摩尔质量为:97g/mol,所以KSCN的质量为:m(KSCN)=![]() ×97g/mol×0.002mol=9.7g,故KSCN的质量分数为:
×97g/mol×0.002mol=9.7g,故KSCN的质量分数为:![]() ,故答案为:滴入一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复;97.0%。
,故答案为:滴入一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复;97.0%。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】如图所示,将大烧杯丙扣在甲乙两个小烧杯(口向上)上。向两个小烧杯中分别装入如下表所列的试剂进行实验。实验现象与预测现象不同的是
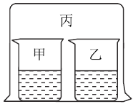
甲中试剂 | 乙中试剂 | 预测现象 | |
A | 浓盐酸 | 硝酸银溶液 | 乙中产生白色沉淀 |
B | 浓氨水 | 硫酸铁溶液 | 乙中产生红褐色沉淀 |
C | 浓盐酸 | 浓氨水 | 丙中产生白色烟雾 |
D | 氯化铝溶液 | 浓氨水并加入 固体氢氧化钠 | 甲中先产生白色沉淀,后又沉淀消失 |
A. AB. BC. CD. D
【题目】已知,反应①:I2(aq)+I-(aq)![]() I3-(aq) △H1;反应②: I3-(aq)
I3-(aq) △H1;反应②: I3-(aq) ![]() I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K1 | 1100 | 841 | 680 | 533 | 409 |
请回答:
(1)若反应②的化学平衡常数为K2,在相同温度下,K1·K2=____________。
(2)上述反应①的△H1_______0(填“>”、“=”、“<”);若升高温度,则I2的溶解速率会______(填“加快”、“减慢”或“不变”)。
(3)能判断反应①已达到平衡的依据是_______________
A.容器中的压强不再改变 B.溶液的颜色不再改变
C.I-浓度不再变化 D.正逆反应速率均为0
(4)某温度下,反应①的化学平衡常数为800。在该温度下,向甲、乙、丙三个容器中分别加入I2和I-,这两种物质的起始浓度如下:
起始浓度(mol/L) | 甲 | 乙 | 丙 |
c(I2) | 0.1 | 0.2 | 0.2 |
c(I-) | 0.2 | 0.1 | 0.2 |
反应速率最快的是_____________(填“甲”、“乙”或“丙”),平衡时I2的转化率最大的是__________(填“甲”、“乙”或“丙”)。
