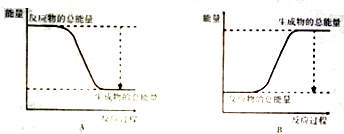
题目内容
9. 镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.(1)Ni在元素周期表中的位置是第四周期,第Ⅷ族.
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子CN-、C22-.配体NH3中N原子的杂化类型为sp3,它可用作致冷剂的原因是液态氨汽化时需吸收大量的热.若[Ni(NH3)6]2+ 为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有2种.
(3)镍常见化合价为+2、+3,在水溶液中通常只以+2价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为[Ar]3d7或1s22s22p63s23p63d7,NiO(OH)溶于浓盐酸的化学方程式为2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O.
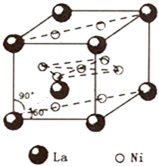
(4)镍和镧(${\;}_{57}^{139}$La)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2.LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6.LaNixH6中,x=5.该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟.
分析 (1)Ni的原子数序为28,位于周期表第四周期第Ⅷ族;
(2)CO的电子数为14,含有2个原子,根据等电子体的定义分析;根据NH3中N原子的δ键判断杂化类型;根据CO的相邻和相对位置判断同分异构体数目;
(3)结合能量最低原理书写离子的电子排布式;NiO(OH)具有氧化性,与盐酸发生氧化还原反应;
(4)利用均摊法计算晶胞的结构.
解答 解:(1)Ni的原子数序为28,位于周期表第四周期第Ⅷ族,
故答案为:第四周期,第Ⅷ族;
(2)CO的电子数为14,含有2个原子,它的等电子体有等CN-、C22-;NH3中N原子形成3个δ键,孤电子对数目孤$\frac{1}{2}$(5-3×1)=1,价层电子对数目为3+1=4,为杂化sp3;氨气易液化,液化时吸收大量的热,可用作制冷剂;[Ni(CO)2(NH3)4]2+的结构中,CO可位于平面的相邻和相对两种位置,
故答案为:CN-、C22-;sp3;液态氨汽化时需吸收大量的热;2;
(3)Ni3+的电子排布式为:[Ar]3d7或1s22s22p63s23p63d7,NiO(OH)具有氧化性,与盐酸发生氧化还原反应,化学方程式为2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O,
故答案为:[Ar]3d7或1s22s22p63s23p63d7;2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O;
(4)由晶胞结构可知,晶胞中La位于顶点,共有8×$\frac{1}{8}$=1,Ni位于面心和体心,面心共有8×$\frac{1}{2}$=4,体心为1,共有5个Ni原子,故该物质中La原子、Ni原子数目之比=1:5,则x=5,
故答案为:5.
点评 本题考查较为综合,涉及物质结构与性质的考查,题目难度中等,本题注意等电子体的判断,利用均摊法计算晶胞的结构,学习中注意杂化类型的判断、电子排布式的书写等方法性的问题.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案| A. | 原子半径:Br<Cl<F | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | D. | 沸点:乙酸>乙醇>乙烷 |
| A. | 仅由非金属元素不可能形成离子化合物 | |
| B. | 构成分子的粒子一定含有共价键 | |
| C. | 离子化合物中可能含有共价键 | |
| D. | 凡是有化学键断裂过程一定发生了化学反应 |
| A. | 电解水 | B. | 酸、碱的中和反应 | ||
| C. | 冰雪融化 | D. | 绿色植物的光合作用 |
| A. | 用含0.1molFeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体粒数为0.1NA | |
| B. | 46gNO2和N2O4的混合气体中含N原子总数为NA | |
| C. | 标准状况下,5.6LCCl4含有的分子数为0.25NA | |
| D. | 0.25molNa2O2中含有的阴离子数为0.5NA |
| A. | H2SO4 | B. | (NH4)2SO4 | C. | NH3•H2O | D. | NH4HSO4 |
 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电反应的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电反应的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列关于此电池说法正确的是( )| A. | 充电过程中,当0.1 mol Na+通过离子交换膜时,导线通过0.1 mol电子 | |
| B. | 电池放电时,负极反应为:3NaBr一2e-═NaBr3+2Na+ | |
| C. | 充电过程中钠离子从右到左通过离子交换膜 | |
| D. | 放电过程中钠离子从左到右通过离子交换膜 |
 ,名称是环己烷
,名称是环己烷 .
.