题目内容
1.用NA表示阿伏伽德罗常数,下列说法正确的是( )| A. | 用含0.1molFeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体粒数为0.1NA | |
| B. | 46gNO2和N2O4的混合气体中含N原子总数为NA | |
| C. | 标准状况下,5.6LCCl4含有的分子数为0.25NA | |
| D. | 0.25molNa2O2中含有的阴离子数为0.5NA |
分析 A.氢氧化铁胶粒为氢氧化铁的聚集体;
B.NO2和N2O4的最简式为NO2,根据最简式计算出混合物中含有N原子数;
C.标准状况下,四氯化碳的状态不是气体;
D.过氧化钠中的阴离子为过氧根离子,0.25mol过氧化钠中含有0.25mol过氧根离子.
解答 解:A.氢氧化铁胶粒为氢氧化铁的聚集体,则无法计算氢氧化铁胶体中含有氢氧化铁胶粒的数目,故A错误;
B.46gNO2和N2O4的混合物中含有46g最简式NO2,含有最简式的物质的量为:$\frac{46g}{46g/mol}$=1mol,1molNO2中含有1molN原子,含N原子总数为NA,故B正确;
C.标况下四氯化碳不是气体,不能使用标况下的气体摩尔体积计算,故C错误;
D.0.25mol过氧化钠中含有0.25mol过氧根离子,含有的阴离子数为0.25NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的计算和判断,题目难度中等,明确标况下气体摩尔体积的使用条件,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.1mol下列物质在足量氧气中充分燃烧,消耗氧气物质的量最多的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 乙醇 |
12.下列有关说法正确的是( )
| A. | 改变物质的性质一定要通过化学变化 | |
| B. | 化学反应必然伴随着能量的变化 | |
| C. | 一种元素可有多种离子,但只有一种原子 | |
| D. | 放热反应一定是不需加热就能发生的 |
16.下列说法错误的是( )
| A. | 在共价化合物中一定含有共价键 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 非金属原子间只能形成共价化合物 |
6.下列实验中,对应的现象以及结论都对应正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B. | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| C. | AgI沉淀中滴加稀KCl溶液 | 有白色沉淀出现 | AgCl的溶度积比AgI的小 |
| D. | 去少量无色溶液,先滴加氯水,再加入少量CCl4,振荡,静置 | 溶液分层,下层呈橙红色 | 原无色溶液中含有溴离子 |
| A. | A | B. | B | C. | C | D. | D |
13.下列关于分子、原子、离子的说法中,正确的是( )
| A. | 分子、原子、离子都显电性 | |
| B. | 分子、原子、离子的质量依次减小 | |
| C. | 分子、原子、离子都能直接构成物质 | |
| D. | 分子可以再分,而原子和离子都不能再分 |
7.下列说法正确的是( )
| A. | 电子层结构相同的离子,随核电荷数的增大其离子半径逐渐减小 | |
| B. | 分子间作用力越强,则分子结构越稳定 | |
| C. | 失电子能力弱的原子得电子能力一定强 | |
| D. | 通过离子键形成的晶体属于离子晶体,通过共价键形成的晶体属于分子晶体 |
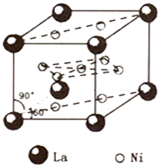 镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.