题目内容
【题目】在溶液中可以大量共存,加OH-产生沉淀,加H+生成气体的一组离子是( )
A.Na+、Cu2+、CO32-、Cl-
B.Na+、 Cl-、 HCO3-、Mg2+
C.Cl-、NO3-、K+、 Ca2+
D.NH4+、 K+、 H+、 SO42-
【答案】B
【解析】
A.Cu2+与CO32-本身不能大量共存会生成碳酸铜沉淀,故A不选;
B.HCO3-在酸性溶液中会生成二氧化碳气体,Mg2+在碱性溶液中会生成白色沉淀,故B选;
C.加H+无气体生成,故C不选;
D.加入H+无气体生成,故D不选;
故选B。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】填写下列空格。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。则由H2和Cl2反应生成1molHCl需要_____(填“放出”或“吸收”)____kJ的热量。
(2)H2可以在Cl2中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____(填“甲”或“乙”)。

(3)已知:H2与Cl2在光照条件下会发生爆炸。同温同压下,反应H2(g)+Cl2(g)=2HCl(g)。在光照和点燃条件下的H_____(填“相等”或“不相等”)。
(4)硅、磷、硫、氯元素的气态氢化物的形成条件和热稳定性如下表所示:
元素符号 | Si | P | S | Cl |
单质与氢气的反应 | 高温下反应 | 磷蒸气与氢气能反应 | 加热时反应 | 光照或点燃时发生爆炸而化合 |
气态氢化物的热稳定性 | 不稳定 | 不稳定 | 受热分解 | 稳定 |
结合元素原子结构等知识,分析以上信息可得出的结论是:同周期非金属元素,随着元素核电荷数的递增,____________________________________,因此,Si、P、S、Cl非金属性依次增强。
【题目】三氯氧磷(POCl3)是一种重要的化工原料,工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3 2PCl3+O2=2POCl3
PCl3、POCl3的部分性质如下:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |
某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去) :
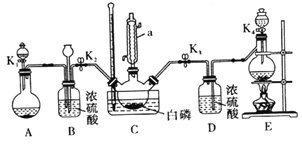
(1)仪器a 的名称为_______________,B装置中长颈漏斗的作用是___________________。
(2)装置E用来制取Cl2,反应的离子方程式为_____________________。
(3)为使实验顺利进行,还需补充的装置为____________________。
(4)反应时,需严格控制三个条件:
①先制取___________,缓慢地通入C 中,直至C 中的白磷消失后,再通入另一种气体。
②C装置用水浴加热控制温度为60 ℃~65℃,除加快反应速率外,另一目的是___________________。
③反应物必须干燥,否则会在C 装置中产生大量的白雾,其主要成分为___________(写化学式)。
(5)反应结束后通过下面步骤测定POCl3产品中Cl 的含量,元素Cl 的质量分数为_______________(写出计算式)。
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH 溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000 mol/L 的AgNO3 溶液40.00 mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用c mol/LNH4SCN溶液滴定过量Ag+ 至终点,记下所用体积为VmL。
(己知:AgPO4溶于酸,Ksp(AgCl )=32×10-10,Ksp(AgSCN )=2×10-12)
