题目内容
【题目】填写下列空格。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。则由H2和Cl2反应生成1molHCl需要_____(填“放出”或“吸收”)____kJ的热量。
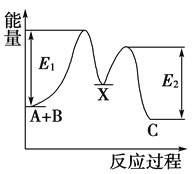
(2)H2可以在Cl2中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____(填“甲”或“乙”)。

(3)已知:H2与Cl2在光照条件下会发生爆炸。同温同压下,反应H2(g)+Cl2(g)=2HCl(g)。在光照和点燃条件下的H_____(填“相等”或“不相等”)。
(4)硅、磷、硫、氯元素的气态氢化物的形成条件和热稳定性如下表所示:
元素符号 | Si | P | S | Cl |
单质与氢气的反应 | 高温下反应 | 磷蒸气与氢气能反应 | 加热时反应 | 光照或点燃时发生爆炸而化合 |
气态氢化物的热稳定性 | 不稳定 | 不稳定 | 受热分解 | 稳定 |
结合元素原子结构等知识,分析以上信息可得出的结论是:同周期非金属元素,随着元素核电荷数的递增,____________________________________,因此,Si、P、S、Cl非金属性依次增强。
【答案】 放出 92.25 甲 相等 原子半径逐渐减小,元素原子得电子能力逐渐增强
【解析】根据反应吸放热的条件进行判定。断键消耗的能量大于成键释放的能量为吸热反应,反之为放热反应。反应热H只与反应物和生成物的状态有关,与途径无关。根据元素周期律知识,同周期元素的非金属性随着原子序数增大而增强, 原子半径依次减小,核对外层电子的引力逐渐增大, 得电子能力逐渐增强的知识解答相关问题。
(1)在H2(g)+Cl2(g)=2HCl(g)反应中断裂1molH-H键、1molCl-Cl键共吸收的能量=436.4kJ+ 242.7kJ=679.1 kJ,生成2molHCl(g) 释放的能量=431.8kJ![]() 2 =863.5 kJ吸收的能量=679.1 kJ <释放出的能量863.5 kJ故该反应为放热反应,需要释放能量, 生成1molHCl释放的能量为:(863.5 kJ-679.1 kJ)/2=92.2 kJ
2 =863.5 kJ吸收的能量=679.1 kJ <释放出的能量863.5 kJ故该反应为放热反应,需要释放能量, 生成1molHCl释放的能量为:(863.5 kJ-679.1 kJ)/2=92.2 kJ
(2)H2在Cl2中燃烧属于放热反应,反应物的总能量大于生成物的总能量,根据图像分析知甲是放热反应,乙是吸热反应,所以能表示H2在Cl2中燃烧反应能量变化的是甲。答案:甲。
(3)反应热H只与反应物和生成物的状态有关,与途径无关,H2与Cl2在光照条件和点燃条件下的反应都是H2(g)+Cl2(g)=2HCl(g)。所以在光照和点燃条件下H相等。答案:相等。
(4) Si、P、S、Cl四种元素原子的电子层数相同,属于同一周期元素,根据实验他们与H2反应的条件的难易程度知非金属性逐渐增强,原因是根据元素周期律知识,同周期元素的非金属性随着原子序数增大而增强, 原子半径依次减小,核对外层电子的引力逐渐增大, 得电子能力逐渐增强。答案:原子半径逐渐减小,元素原子得电子能力逐渐增强。