题目内容
【题目】合理控制、利用燃煤排放的CO2、SO2、CO是优化环境的有效途径。
(1)CO2生产甲醇方法:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH =a kJ·mol1;
CH3OH(g)+H2O(g) ΔH =a kJ·mol1;
已知:2H2(g)+O2(g)===2H2O(g) ΔH=b kJ·mol1;
H2O(g)===H2O(l) ΔH=c kJ·mol1;
CH3OH(g)===CH3OH(l) ΔH=d kJ·mol1。
则表示CH3OH(l)燃烧热的热化学方程式为_________________________________。
(2)工业生产中用SO2为原料制取硫酸


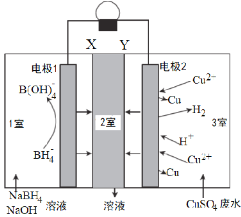
①利用原电池将SO2 转化法,如图(a)所示,则负极的电极反应式为____________。
②电解Na2SO3溶液吸收SO2得到的NaHSO3法,如图(b)所示,则阳极反应式______。
(3)光气 (COCl2)是一种重要的化工原料,工业上通过Cl2(g)+CO(g) ![]() COCl2(g)的反应制备。根据图(c)、图(d),回答下列问题:
COCl2(g)的反应制备。根据图(c)、图(d),回答下列问题:

①该反应的正反应是___________ 反应(填“放热”或“吸热”)。
②0~6 min内,反应的平均速率v(Cl2)=_______;该温度下的平衡常数为______。
③若恒温恒容时,在第7 min 向体系中加入这三种物质各2 mol,则平衡_____移动(填“向左”、“向右”或“不”)。
④若恒温恒压时,初始投料浓度为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol·L1、c(COCl2)=______mol·L1,最终达到化学平衡时,Cl2的体积分数与上述第6 min时的相同。
⑤第n min反应温度表示为T(n ),则:T(8)_____T(15) (填“>”、“<”或“=”)。
【答案】CH3OH(l)+![]() O2(g) =CO2(g)+2H2O(l) △H=(
O2(g) =CO2(g)+2H2O(l) △H=(![]() b+2cad)kJ·mol1 SO22e+2H2O===4H++SO42- HSO3-+H2O-2e-===SO42-+3H+ 放热 0.15 mol·L1·min1 30 向右 0.5 <
b+2cad)kJ·mol1 SO22e+2H2O===4H++SO42- HSO3-+H2O-2e-===SO42-+3H+ 放热 0.15 mol·L1·min1 30 向右 0.5 <
【解析】
(1)已知:①CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH =a kJ·mol1;②2H2(g)+O2(g)= 2H2O(g) ΔH=b kJ·mol1;③H2O(g) =H2O(l) ΔH=c kJ·mol1;④CH3OH(g) =CH3OH(l) ΔH=d kJ·mol1;根据盖斯定律,②×
CH3OH(g)+H2O(g) ΔH =a kJ·mol1;②2H2(g)+O2(g)= 2H2O(g) ΔH=b kJ·mol1;③H2O(g) =H2O(l) ΔH=c kJ·mol1;④CH3OH(g) =CH3OH(l) ΔH=d kJ·mol1;根据盖斯定律,②×![]() +③×2-①-④即可得CH3OH(l)+
+③×2-①-④即可得CH3OH(l)+![]() O2(g) =CO2(g)+2H2O(l),据此计算△H;
O2(g) =CO2(g)+2H2O(l),据此计算△H;
(2)①依据原电池原理,负极是失电子发生氧化反应,二氧化硫失电子生成硫酸的过程;
②根据化合价变化判断阳极反应物质,写出阳极反应式;
(3)①图(c)可知,达到平衡后升高温度,平衡逆向移动;
②由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L-0.3mol/L=0.9mol/L,根据v=![]() 计算v(Cl2);该温度下的平衡常数K=
计算v(Cl2);该温度下的平衡常数K=![]() ;
;
③原平衡时n(Cl2):n(CO):n(COCl2)=3:1:9,现在第7 min 向体系中加入这三种物质各2 mol,则反应物的浓度增大程度大些,平衡正向移动;
④改变初始投料浓度,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同,则为等效平衡,完全转化到左边满足Cl2浓度为1.2mol/L、CO浓度为1.0mol/L;
⑤第8min反应处于平衡状态,在第10分钟时是改变温度使平衡向逆反应方向移动,由①升温平衡向逆反应方向移动,可知正反应为放热反应,升高温度平衡向逆反应方向移动。
(1)已知:①CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH =a kJ·mol1;②2H2(g)+O2(g)= 2H2O(g) ΔH=b kJ·mol1;③H2O(g) =H2O(l) ΔH=c kJ·mol1;④CH3OH(g) =CH3OH(l) ΔH=d kJ·mol1;根据盖斯定律,②×
CH3OH(g)+H2O(g) ΔH =a kJ·mol1;②2H2(g)+O2(g)= 2H2O(g) ΔH=b kJ·mol1;③H2O(g) =H2O(l) ΔH=c kJ·mol1;④CH3OH(g) =CH3OH(l) ΔH=d kJ·mol1;根据盖斯定律,②×![]() +③×2-①-④即可得CH3OH(l)+
+③×2-①-④即可得CH3OH(l)+![]() O2(g) ===CO2(g)+2H2O(l),则△H=(
O2(g) ===CO2(g)+2H2O(l),则△H=(![]() b+2cad)kJ·mol1,故表示CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+
b+2cad)kJ·mol1,故表示CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+![]() O2(g) =CO2(g)+2H2O(l) △H=(
O2(g) =CO2(g)+2H2O(l) △H=(![]() b+2cad)kJ·mol1;
b+2cad)kJ·mol1;
(2)①该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+;
②电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+;
(3)①图(c)可知,达到平衡后升高温度,平衡逆向移动,则该反应的正反应是放热反应;
②由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L-0.3mol/L=0.9mol/L,则v(Cl2)==![]() =
=![]() =0.15 mol·L1·min1;
=0.15 mol·L1·min1;
平衡时,c(COCl2)= 0.9mol/L,c(CO)= 0.1mol/L,则该温度下的平衡常数K=![]() =
=![]() =30;
=30;
③6min时,平衡时c(Cl2)=0.3mol/L、c(CO)=0.1mol/L、c(COCl2)=0.9mol/L,则原平衡时n(Cl2):n(CO):n(COCl2)=3:1:9,现在第7min 加入体系中的三种物质各2mol,则反应物的浓度增大程度大些,平衡正向移动,即平衡向右移动;
④最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同,即与原平衡为等效平衡,完全转化到左边满足Cl2浓度为1.2mol/L、CO浓度为1.0mol/L,则:c(Cl2)0.7mol/L+c(COCl2)=1.2mol/L,c(CO)=0.5mol/L+c(COCl2)=1.0mol/L,故c(COCl2)=0.5mol/L;
⑤根据图象,第8min反应处于平衡状态,在第10分钟时是改变温度使平衡向逆反应方向移动,由①升温平衡向逆反应方向移动,可知正反应为放热反应,升高温度平衡向逆反应方向移动,故T(8)<T(15)。