题目内容
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中 E1 表示无催化剂时正反应的活化能,E2 表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中 E1 表示无催化剂时正反应的活化能,E2 表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
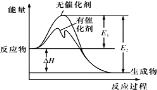
A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B.该反应中,反应物的总键能大于生成物的总键能
C.500℃、101kPa 下,将 1molSO2(g)和 0.5molO2(g)置于密闭容器中充分反应生成 SO3(g)放热 akJ,其热化学方程式为 2SO2(g) + O2(g)![]() 2SO3(g) ΔH<-2a kJ·mol-l
2SO3(g) ΔH<-2a kJ·mol-l
D.ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
【答案】B
【解析】
由图可知,该反应反应物总能量大于生成物总能量,所以正反应为放热反应。
A. 该反应正反应为放热反应,所以逆反应为吸热反应,升高温度,提供能量,可提高活化分子的百分数,加快反应速率,A正确;
B. 该反应为放热反应,ΔH<0,断裂化学键所吸收的能量小于形成化学键所放出的能量,所以反应物的总键能小于生成物的总键能,B错误;
C. 反应2SO2(g) + O2(g)![]() 2SO3(g)为可逆反应,所以1molSO2和 0.5molO2不可能完全反应,生成的SO3小于1mol,生成2mol SO3时放热大于2akJ,故热化学方程式为 2SO2(g) + O2(g)
2SO3(g)为可逆反应,所以1molSO2和 0.5molO2不可能完全反应,生成的SO3小于1mol,生成2mol SO3时放热大于2akJ,故热化学方程式为 2SO2(g) + O2(g)![]() 2SO3(g) ΔH <-2a kJ·mol-l,C正确;
2SO3(g) ΔH <-2a kJ·mol-l,C正确;
D. 焓变等于正逆反应活化能之差,则ΔH=E1-E2,使用催化剂改变活化能,改变反应速率,但不改变反应热,D正确。
答案选B。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】下列实验操作不能达到相应实验目的的是
选项 | 实验操作 | 实验目的 |
A | 向苯与液溴的混合液中加入铁粉,将产生的气体直接通入AgNO3溶液中 | 验证液溴与苯发生取代反应 |
B | 向5mL浓度为0.5mol·L-1的KI溶液中滴加少量氯化铁溶液,再加入少量淀粉溶液,振荡 | 比较I-、Fe2+的还原性强弱 |
C | 向5mL浓度为0.2mol·L-1的MgCl2溶液中滴加少量NaOH溶液,待有白色沉淀生成后,再滴加0.2mol·L-1的CuCl2溶液 | 比较Cu(OH)2、Mg(OH)2溶度积的大小 |
D | 向 | 验证与H+的结合能力: |
A.AB.BC.CD.D









