题目内容
【题目】室温下,利用如图所示,可回收酸性废水中低浓度的铜,下列说法错误的是
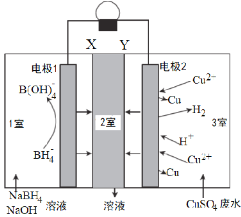
A.电极2为正极,只发生反应:Cu2++2e—=Cu
B.Y为阴离子交换膜,2室流出的溶液是Na2SO4溶液
C.每8molNaOH参加反应,有8mol电子转移
D.此装置在回收铜的同时还有电流产生
【答案】A
【解析】
由图可知,该装置为原电池。电极1处BH4-转化为B(OH)4-,发生氧化反应,故电极1为负极,电极方程式为:BH4-+8OH--8e-= B(OH)4-+4H2O。该反应导致1室中负电荷的减少,故1室中的阳离子会流入2室。电极2处Cu2+和H+转化为Cu和H2,发生还原反应,故电极2为正极,电极反应为:Cu2++2e-=Cu,2H++2e-= H2。该反应导致3室中阳离子减少,故3室中的阴离子流向2室。
A.根据分析,电极2为正极,电极反应为:Cu2++2e-=Cu,2H++2e-= H2,A错误;
B.根据分析,故1室中的阳离子(Na+)及3室中的阴离子(SO42-)会流入2室,故Y为阴离子交换膜,2室流出的溶液是Na2SO4溶液,B正确;
C.根据负极反应:BH4-+8OH--8e-=,B(OH)4-+4H2O,OH-与电子计量数之比为1:1,故每8molNaOH参加反应,有8mol电子转移,C正确;
D.该装置为原电池,有电流产生;正极反应中有Cu2++2e-=Cu,故可以回收Cu,D正确;
故选A。

练习册系列答案
相关题目