题目内容
【题目】已知草酸(H2C2O4)为二元弱酸,25℃时,Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5。用NaOH溶液滴定草酸氢钾(KHC2O4)溶液,混合溶液的相对导电能力随加入NaOH体积的变化如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列有关描述中正确的是
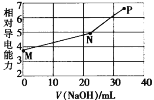
A.M点粒子浓度:c(K+)>c(![]() )>c(
)>c(![]() )>c(H2C2O4)
)>c(H2C2O4)
B.N点时存在:c(Na+)+c(K+)<2c(![]() )+2c(
)+2c(![]() )
)
C.从N点到P点的过程中溶液中一定存在:c(Na+)+c(H2C2O4)>c(![]() )
)
D.水的电离程度大小顺序:P>N>M
【答案】AC
【解析】
M点时还未加入氢氧化钠溶液,体系中为KHC2O4溶液,根据电离平衡常数判断![]() 水解和电离程度的大小;N点为反应终点:2NaOH+2KHC2O4=2H2O+ K2C2O4+ Na2C2O4,P中存在K2C2O4、Na2C2O4和过量的NaOH,可水解的盐促进水的电离、酸和碱抑制水的电离,由此进行解题。
水解和电离程度的大小;N点为反应终点:2NaOH+2KHC2O4=2H2O+ K2C2O4+ Na2C2O4,P中存在K2C2O4、Na2C2O4和过量的NaOH,可水解的盐促进水的电离、酸和碱抑制水的电离,由此进行解题。
A.M点时还未加入氢氧化钠溶液,体系中为KHC2O4溶液,HC2O4-会水解:![]() +H2OH2C2O4+OH-, Kh(
+H2OH2C2O4+OH-, Kh(![]() )=
)=![]() =
=![]() =
=![]() =1.7×10-13,HC2O4-也会电离:
=1.7×10-13,HC2O4-也会电离:![]()
![]() +H+,由于Kh(
+H+,由于Kh(![]() )<Ka2,草酸氢根在溶液中的电离程度大于其水解程度,显酸性,故粒子浓度:c(K+)>c(
)<Ka2,草酸氢根在溶液中的电离程度大于其水解程度,显酸性,故粒子浓度:c(K+)>c(![]() )>c(
)>c(![]() )>c(H2C2O4),A正确;
)>c(H2C2O4),A正确;
B.N点为反应终点:2NaOH+2KHC2O4=2H2O+ K2C2O4+ Na2C2O4,根据物料守恒可推出:c(Na+)+c(K+)=2c(![]() )+2c(
)+2c(![]() )+2c(H2C2O4),所以N点时存在:c(Na+)+c(K+)>2c(
)+2c(H2C2O4),所以N点时存在:c(Na+)+c(K+)>2c(![]() )+2c(
)+2c(![]() ),B错误;
),B错误;
C.从N点到P点的过程中,溶液中存在K2C2O4、Na2C2O4和NaOH (K2C2O4:Na2C2O4=1:1),![]() 水解生成
水解生成![]() 、H2C2O4,故c(Na+)>c(
、H2C2O4,故c(Na+)>c(![]() ),故溶液中一定存在:c(Na+)+c(H2C2O4)>c(
),故溶液中一定存在:c(Na+)+c(H2C2O4)>c(![]() ),C正确;
),C正确;
D.根据A项分析,M点![]() 的微弱电离抑制水的电离,N点由于
的微弱电离抑制水的电离,N点由于![]() 的水解促进水的电离,P中存在过量的NaOH抑制水的电离,则水的电离程度大小顺序为: N>M>P,D错误;
的水解促进水的电离,P中存在过量的NaOH抑制水的电离,则水的电离程度大小顺序为: N>M>P,D错误;
答案选AC。

【题目】下列实验操作不能达到相应实验目的的是
选项 | 实验操作 | 实验目的 |
A | 向苯与液溴的混合液中加入铁粉,将产生的气体直接通入AgNO3溶液中 | 验证液溴与苯发生取代反应 |
B | 向5mL浓度为0.5mol·L-1的KI溶液中滴加少量氯化铁溶液,再加入少量淀粉溶液,振荡 | 比较I-、Fe2+的还原性强弱 |
C | 向5mL浓度为0.2mol·L-1的MgCl2溶液中滴加少量NaOH溶液,待有白色沉淀生成后,再滴加0.2mol·L-1的CuCl2溶液 | 比较Cu(OH)2、Mg(OH)2溶度积的大小 |
D | 向 | 验证与H+的结合能力: |
A.AB.BC.CD.D
【题目】表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
A | B | C | ||
D | ||||
A.原子半径大小比较为D>C>B>A
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC![]() 、A2C
、A2C![]()
D.A、B、C、D的单质常温下均不导电