题目内容
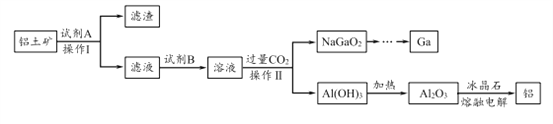
【题目】铝(熔点660℃)是一种应用广泛的金属,镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业上以铝土矿(含有Al2O3、Ga2O3、SiO2等物质)为原料提取Al2O3(熔点2045℃),并将Al2O3和冰晶石(Na3AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(1)冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,写出铝与CrO3在高温下反应的化学方程式 ___________________。
(2)操作I得到滤渣的主要成分有________________ 。
(3)将0.1 mol/L AlCl3溶液和10% NH4F溶液等体积混合,充分反应后滴加氨水,无沉淀析出。则AlCl3与NH4F反应的化学方程式为 ________________ ;该实验所用试管及盛装NH4F溶液的试剂瓶均为塑料材质,原因是 _________________________。
(4)饮用水中的NO3-对人类健康会产生危害。为了降低饮用水中的NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________ ,此方法的缺点是处理后的水中生成了AlO2-,仍然可能对人类健康产生危害,还需对该饮用水进行一系列后续处理。已知:25℃时,Ksp[Al(OH)3]=1.3×10-33,Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH=____,此时水中
AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH=____,此时水中![]() =__________。
=__________。
(5)工业上常用碳棒作电极电解熔融氧化铝的方法冶炼铝(如图所示)。
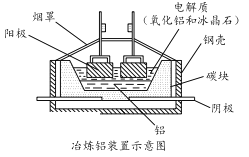
①阴极电极反应式为________________________ 。
②工业生产中,阳极材料要定期补充,其原因是:____________________。
(6)下列有关推理不合理的是 ______。
a.工业上可以用热还原法来制取Ga
b.酸性:Al(OH)3>Ga(OH)3
c.由最外层电子数相同可知,镓与铝的化学性质相似
d.可用GaCl3溶液、氨水和盐酸设计实验证明Ga(OH)3的两性
【答案】 CrO3 + 2Al![]() Al2O3 + Cr SiO2 AlCl3+6NH4F=(NH4)3AlF6+3NH4Cl NH4F电离出的F-水解生成HF,对玻璃有强腐蚀性而对塑料则无腐蚀性 10Al+6NO3-+4OH-=3N2↑+10AlO2-+2H2O 7 1.3×10-12 mol/L Al3+ +3e- =Al 阳极产生的氧气与阳极材料中的碳发生反应 abd
Al2O3 + Cr SiO2 AlCl3+6NH4F=(NH4)3AlF6+3NH4Cl NH4F电离出的F-水解生成HF,对玻璃有强腐蚀性而对塑料则无腐蚀性 10Al+6NO3-+4OH-=3N2↑+10AlO2-+2H2O 7 1.3×10-12 mol/L Al3+ +3e- =Al 阳极产生的氧气与阳极材料中的碳发生反应 abd
【解析】考查化学工艺流程,(1)铝作还原剂,把Cr置换出来,其反应方程式为2Al+CrO3![]() Al2O3+Cr;(2)Al2O3和Ga2O3都属于两性氧化物,SiO2属于酸性氧化物,因此试剂A应为酸,即滤渣的主要成分是SiO2;(3)根据题意,氯化铝和氟化铵反应生成六氟合铝酸铵和氯化铵,因此AlCl3与NH4F反应的方程式为AlCl3+6NH4F=(NH4)3AlF6+3NH4Cl;氟化铵中F-水解产生HF,氢氟酸腐蚀玻璃,因此实验所用试管及盛装NH4F溶液的试剂瓶均为塑料材质;(4)根据信息,Al被氧化成AlO2-,NO3-被还原成N2,因此离子反应方程式为10Al+6NO3-+4OH-=3N2↑+10AlO2-+2H2O ; 平衡常数K=c(AlO2-)×c(H+),因此c(H+)=K/c(AlO2-)=1.0×10-13/1.0×10-6mol·L-1=1.0×10-7mol·L-1,即pH=7,c(Al3+)=Ksp/c3(OH-)=1.3×10 -33/(1.0×10-7)3=1.3×10-12mol·L-1;(5)①阴极上发生还原反应,即阴极反应式为Al3++3e-=Al;②阳极产生的氧气与阳极材料中的碳发生反应;(6)a、Al与Ga属于同主族,因此工业上常用电解法制取Ga,故a错误;b、溶液中通入过量的CO2,只有Al(OH)3沉淀生成,说明酸性强弱顺序是Ga(OH)3>H2CO3>Al(OH)3,故b错误;c、Ga与Al属于同主族,最外层电子数相同,化学性质相似,故c正确;d、根据氢氧化铝溶于强碱不溶于弱碱,因此用氢氧化钠替代氨水,故d错误。
Al2O3+Cr;(2)Al2O3和Ga2O3都属于两性氧化物,SiO2属于酸性氧化物,因此试剂A应为酸,即滤渣的主要成分是SiO2;(3)根据题意,氯化铝和氟化铵反应生成六氟合铝酸铵和氯化铵,因此AlCl3与NH4F反应的方程式为AlCl3+6NH4F=(NH4)3AlF6+3NH4Cl;氟化铵中F-水解产生HF,氢氟酸腐蚀玻璃,因此实验所用试管及盛装NH4F溶液的试剂瓶均为塑料材质;(4)根据信息,Al被氧化成AlO2-,NO3-被还原成N2,因此离子反应方程式为10Al+6NO3-+4OH-=3N2↑+10AlO2-+2H2O ; 平衡常数K=c(AlO2-)×c(H+),因此c(H+)=K/c(AlO2-)=1.0×10-13/1.0×10-6mol·L-1=1.0×10-7mol·L-1,即pH=7,c(Al3+)=Ksp/c3(OH-)=1.3×10 -33/(1.0×10-7)3=1.3×10-12mol·L-1;(5)①阴极上发生还原反应,即阴极反应式为Al3++3e-=Al;②阳极产生的氧气与阳极材料中的碳发生反应;(6)a、Al与Ga属于同主族,因此工业上常用电解法制取Ga,故a错误;b、溶液中通入过量的CO2,只有Al(OH)3沉淀生成,说明酸性强弱顺序是Ga(OH)3>H2CO3>Al(OH)3,故b错误;c、Ga与Al属于同主族,最外层电子数相同,化学性质相似,故c正确;d、根据氢氧化铝溶于强碱不溶于弱碱,因此用氢氧化钠替代氨水,故d错误。

 阅读快车系列答案
阅读快车系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为 .