题目内容
【题目】硫是中学化学重要的非金属元素之一,请回答下列有关问题。
已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJ/mol
2SO3(g) △H=-196.6kJ/mol
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJ/mol
2NO2(g) △H=-113.0kJ/mol
(1)反应NO2(g)+ SO2(g)![]() SO3(g)+NO(g)的ΔH= ______kJ/mol 。
SO3(g)+NO(g)的ΔH= ______kJ/mol 。
(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 _________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时消耗1 molNO
(3)S2Cl2和SCl2均为重要的工业化合物。已知:
a.S2(l)+Cl2(g)![]() S2Cl2(g) △H1
S2Cl2(g) △H1
b.S2Cl2(g)+ Cl2(g)![]() 2SCl2(g) △H2
2SCl2(g) △H2
—定压强下,向10 L密闭容器中充入1 molS2Cl2和1 mol Cl2,发生反应b。Cl2与SCl2的消耗速率(υ)与温度(T)的关系如图所示:
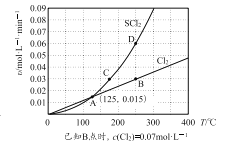
① A、B、C、D四点对应状态下,达到平衡状态的有______(填字母),理由是_______。
②—定温度下,在恒容密闭容器中发生反应a和反应b,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率_________(填“增大”或“减小”或“不变”),理由是________。
II.氮有不同价态的化合物,如氨、氮气、亚硝酸钠、乙二胺等。
图(I)和图(II)分别为二元酸H2A和乙二胺(H2NCH2CH2NH2)溶液中各微粒的百分含量δ(即物质的量百分数)随溶液pH的变化曲线(25℃)。
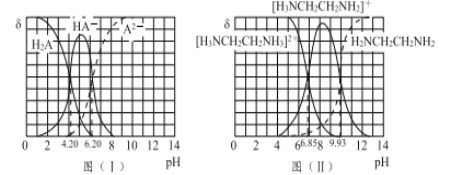
(1)H3NCH2CH2NH3A溶液显____(填“酸”或“碱”)性。
(2)乙二胺在水溶液中发生第二步电离的方程式:____________________,其平衡常数Kb2= _______________________ 。
(3)向20 mL 0.1 mol/L的H2A溶液加入10 mL 0.1 mol/L H2NCH2CH2NH2溶液后,溶液中各离子浓度大小的关系为 ____________________________________。
【答案】 -41.8 bd BD B、D两点对应的状态下,用同一物质表示的正、逆反应速率相等 不变 反应a和反应b均为左右两边气体分子总数相等的反应,压强对平衡没有影响 酸 [H3NCH2CH2NH2]++H2O ![]() [H3NCH2CH2NH2]2++OH- Kb2=10-7.15 c([H3NCH2CH2NH2]+)>c(HA-)>c(A2-)>c([H3NCH2CH2NH3]2+)>c(H+)>c(OH-)
[H3NCH2CH2NH2]2++OH- Kb2=10-7.15 c([H3NCH2CH2NH2]+)>c(HA-)>c(A2-)>c([H3NCH2CH2NH3]2+)>c(H+)>c(OH-)
【解析】I.(1)考查热化学反应方程式的计算,①2SO2(g)+O2(g)![]() 2SO3(g),②2NO(g)+O2(g)
2SO3(g),②2NO(g)+O2(g)![]() 2NO2(g),(①-②)/2,得出:△H=(113.0-196.6)/2kJ·mol-1=-41.8kJ·mol-1;(2)考查化学平衡状态的判断,a、反应前后气体系数之和相等,因此压强始终保持不变,即压强不变,不能说明反应达到平衡,故a错误;b、NO2显红棕色,其余均为无色,因此颜色不变,说明反应达到平衡,故b正确;c、SO2和NO系数相等,因此SO3和NO的体积比始终保持不变,故c错误;d、消耗1molSO2,说明反应向正反应方向移动,消耗1molNO,说明反应向逆反应方向移动,且两者消耗量等于系数之比,因此能说明反应达到平衡,故d正确;(3)考查勒夏特列原理,①消耗Cl2,反应向正反应方向进行,消耗SCl2,反应向逆反应方向进行,当氯气的消耗速率是SCl2消耗速率的一半时,反应达到平衡,即BD点达到平衡,原因是B、D两点对应的状态下,用同一物质表示的正、逆反应速率相等;②反应a和反应b均为左右两边气体分子总数相等的反应,压强对平衡没有影响,因此氯气的平衡转化率不变;II.(1)考查溶液酸碱性的判断,根据图1,当pH=6.20时,A2-的水解平衡常数为K=c(OH-)×c(HA-)/c(A2-),c(A-)=c(HA-),即A2-水解平衡常数K=c(OH-)=10-(14-6.2)=10-7.8,[H3NCH2CH2NH2]+的水解平衡常数K=c([H3NCH2CH2NH2]+)×c(H+)/c([H3NCH2CH2NH)]2+),当pH=6.85时,c([H3NCH2CH2NH2]+)=c([H3NCH2CH2NH)]2+),即水解平衡常数为K=c(H+)=10-6.85mol·L-1,[H3NCH2CH2NH2]+的水解平衡常数大于A2-的水解平衡常数,溶液显酸性;(2)应分步电离,即第二步电离的方程式为[H3NCH2CH2NH2]++H2O
2NO2(g),(①-②)/2,得出:△H=(113.0-196.6)/2kJ·mol-1=-41.8kJ·mol-1;(2)考查化学平衡状态的判断,a、反应前后气体系数之和相等,因此压强始终保持不变,即压强不变,不能说明反应达到平衡,故a错误;b、NO2显红棕色,其余均为无色,因此颜色不变,说明反应达到平衡,故b正确;c、SO2和NO系数相等,因此SO3和NO的体积比始终保持不变,故c错误;d、消耗1molSO2,说明反应向正反应方向移动,消耗1molNO,说明反应向逆反应方向移动,且两者消耗量等于系数之比,因此能说明反应达到平衡,故d正确;(3)考查勒夏特列原理,①消耗Cl2,反应向正反应方向进行,消耗SCl2,反应向逆反应方向进行,当氯气的消耗速率是SCl2消耗速率的一半时,反应达到平衡,即BD点达到平衡,原因是B、D两点对应的状态下,用同一物质表示的正、逆反应速率相等;②反应a和反应b均为左右两边气体分子总数相等的反应,压强对平衡没有影响,因此氯气的平衡转化率不变;II.(1)考查溶液酸碱性的判断,根据图1,当pH=6.20时,A2-的水解平衡常数为K=c(OH-)×c(HA-)/c(A2-),c(A-)=c(HA-),即A2-水解平衡常数K=c(OH-)=10-(14-6.2)=10-7.8,[H3NCH2CH2NH2]+的水解平衡常数K=c([H3NCH2CH2NH2]+)×c(H+)/c([H3NCH2CH2NH)]2+),当pH=6.85时,c([H3NCH2CH2NH2]+)=c([H3NCH2CH2NH)]2+),即水解平衡常数为K=c(H+)=10-6.85mol·L-1,[H3NCH2CH2NH2]+的水解平衡常数大于A2-的水解平衡常数,溶液显酸性;(2)应分步电离,即第二步电离的方程式为[H3NCH2CH2NH2]++H2O ![]() [H3NCH2CH2NH2]2++OH-;平衡常数只受温度的影响,即pH=6.85时,c([H3NCH2CH2NH2]+)=c([H3NCH2CH2NH)]2+),其平衡常数Kb2=10-7.15 ;(3)根据所给量,因此离子浓度大小顺序是c([H3NCH2CH2NH2]+)>c(HA-)>c(A2-)>c([H3NCH2CH2NH3]2+)>c(H+)>c(OH-)。
[H3NCH2CH2NH2]2++OH-;平衡常数只受温度的影响,即pH=6.85时,c([H3NCH2CH2NH2]+)=c([H3NCH2CH2NH)]2+),其平衡常数Kb2=10-7.15 ;(3)根据所给量,因此离子浓度大小顺序是c([H3NCH2CH2NH2]+)>c(HA-)>c(A2-)>c([H3NCH2CH2NH3]2+)>c(H+)>c(OH-)。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案