题目内容
17.写出下列化合物的名称或结构简式: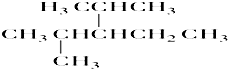 .
.①2.4-二甲基-3-乙基戊烷.
②2,5二甲基 2,4己二醇的结构简式:HO-C(CH3)2-CH2-CH(OH)-CH(CH3)2.
分析 依据烷烃系统命名原则及其结构特点解答;
烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
解答 解:①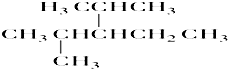 ,主链上有5个碳原子,2,4号碳原子上各有1个甲基,3号碳原子上有1个乙基,其系统命名为:2.4-二甲基-3-乙基戊烷;
,主链上有5个碳原子,2,4号碳原子上各有1个甲基,3号碳原子上有1个乙基,其系统命名为:2.4-二甲基-3-乙基戊烷;
故答案为:2.4-二甲基-3-乙基戊烷;
②2,5二甲基 2,4己二醇,主链上有6个碳原子,2,5号碳上各有1个甲基,2,6号碳上各有1个羟基,其结构简式为:HO-C(CH3)2-CH2-CH(OH)-CH(CH3)2,
故答案为:HO-C(CH3)2-CH2-CH(OH)-CH(CH3)2.
点评 本题考查了有机物的命名,结构简式的书写,题目难度中等,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,题目难度不大.

练习册系列答案
相关题目
8.下列叙述正确的是( )
| A. | 同主族金属的原子半径越大,熔点越高 | |
| B. | 分子间作用力越强,分子晶体的熔点越高 | |
| C. | 稀有气体原子序数越大,熔点越低 | |
| D. | 同周期元素的原子半径越小,越易失去电子 |
5.某兴趣小组为探究温度、压强对可逆反应A(g)+B(g)?C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1].然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3].
请找
出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是( )
请找
| A | B | C | |
| 浓度1 | 0.05mol•L-1 | amol•L-1 | 0.05mol•L-1 |
| 浓度2 | 0.078mol•L-1 | 0.078mol•L-1 | 0.122mol•L-1 |
| 浓度3 | 0.06mol•L-1 | 0.06mol•L-1 | 0.04mol•L-1 |
| 浓度4 | 0.07mol•L-1 | 0.07mol•L-1 | 0.098mol•L-1 |
| A. | 由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应 | |
| B. | 由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度 | |
| C. | [浓度1]中a=0.05mol•L-1 | |
| D. | 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4].与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差 |
12.已知有热化学方程式:SO2(g)+1/2O2(g)=SO3(g);△H=-98.32kJ/mol.现有2molSO2参加反应,当放出137.5kJ热量时,SO2的转化率最接近于( )
| A. | 40% | B. | 50% | C. | 70% | D. | 90% |
2.某河道两旁有甲乙两厂.它们排放的工业废水中(均无沉淀),共含K+、Ag+、Fe3+、C1-、OH-、NO3- 六种离子.甲厂的废水明显呈碱性,请问乙厂的废水中含有几种离子?( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
9.下列反应中生成物的总能量大于反应物总能量的是( )
| A. | 稀硫酸与氢氧化钾溶液的反应 | B. | 氢气还原氧化铜的反应 | ||
| C. | 锌与稀硫酸的反应 | D. | 生石灰变成熟石灰的反应 |
6.下列混合物的分离方法不正确的是( )
| A. | 泥沙和食盐(溶解,过滤) | B. | 汽油和水(分液) | ||
| C. | KNO3和KCl(降温结晶) | D. | 酒精和水(分液) |
7.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质熔融状态下能导电.下列有关分析正确的是( )
| A. | K3C60和C60中都含有共价键 | |
| B. | 钾的核外电子排布为:1s22s22p63s23p63d104s1 | |
| C. | K3C60和C60都属于分子晶体,具有较低的熔点 | |
| D. | C60与12C互为同素异形体 |