题目内容
9.下列离子方程式书写正确的是( )| A. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸钡溶于稀硝酸:BaCO3+2H+=Ba2++CO2↑+H2O | |
| C. | 实验室用大理石与盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O | |
| D. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ |
分析 A.反应生成硫酸亚铁和氢气;
B.反应生成硝酸钡、水、二氧化碳;
C.碳酸钙在离子反应中保留化学式;
D.电子不守恒.
解答 解:A.铁和稀硫酸反应的离子反应为Fe+2H+=Fe2++H2↑,故A错误;
B.碳酸钡溶于稀硝酸的离子反应为BaCO3+2H+=Ba2++CO2↑+H2O,故B正确;
C.实验室用大理石与盐酸反应制取二氧化碳的离子反应为CaCO3+2H+=Ca2++CO2↑+H2O,故C错误;
D.钠与水的反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列说法不正确的是( )
| A. | 乙烯、乙醇均能使酸性高锰酸钾溶液褪色 | |
| B. | 通过乙烷的取代反应或乙烯的加成反应都可以制取纯净的氯乙烷 | |
| C. | 乙烯、环己烷都属于烃类,它们通式相同,但它们不互为同系物 | |
| D. | 烯烃完全燃烧时,生成CO2和H2O的物质的量相等 |
20.一定条件下,体积为1L的密闭容器中,2mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A. | 若增大压强,则混合气体的平均分子量减小 | |
| B. | 将容器体积变为0.5 L,Z的平衡浓度变为原来的2倍 | |
| C. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| D. | 保持体积不变,向其中充入1 mol He气体,平衡右移 |
17. 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )
 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )| A. | X、Y均为气体单质 | |
| B. | X、Y的相对分子质量相等 | |
| C. | n(H2)<n(X)=n(Y) | |
| D. | 隔板停止滑动时,A、B、C三部分体积相等 |
1.下列有关说法正确的是( )
| A. | H2O2→O2的变化过程中,必须要加入合适的氧化剂才能实现 | |
| B. | Al2O3+3C+N2═2AlN+3CO中,Al2O3是氧化剂 | |
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中MnO2是还原剂 | |
| D. | 有金属单质参加的反应中,金属单质一定作还原剂 |
6.NiSO4是一种重要的化工原料,大量用于电镀、触媒和纺织品染色等.某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al、Fe的单质及氧化物,其他不溶杂质.
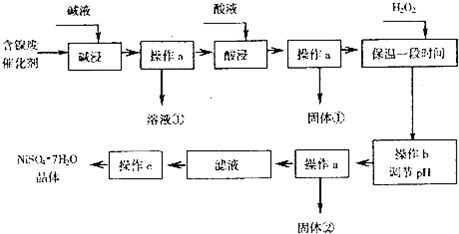
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、漏斗、玻璃棒外还需要的主要仪器为蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑,Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)在40℃左右,用6%的H2O2能氧化Fe2+此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀而把铁除去.图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾钠稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10-39).下列说法正确的是CD(选填序号).
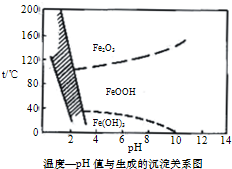
A.FeOOH中铁为+2价
B.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
C.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O
D.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(5)操作b调节pH的范围为3.2-7.1.
(6)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、漏斗、玻璃棒外还需要的主要仪器为蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑,Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)在40℃左右,用6%的H2O2能氧化Fe2+此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀而把铁除去.图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾钠稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10-39).下列说法正确的是CD(选填序号).

A.FeOOH中铁为+2价
B.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
C.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O
D.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(5)操作b调节pH的范围为3.2-7.1.
(6)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.
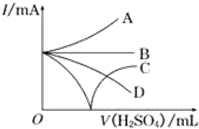 向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题: