题目内容
18.活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1-100纳米.某化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下: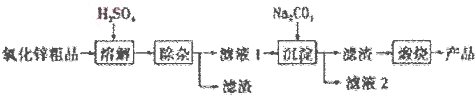
(1)通过焰色反应(填操作名称)可以检验流程中滤液2中含有Na+.
(2)若上述流程图中Na2CO3溶液的pH=12,下列说法正确的是BC.
A该溶液中c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B.该溶液中c(Na+)+c(H+)>c(CO32-)+2c(HCO3-)+c(OH-)
C.该溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D.若将该溶液稀释至100倍,则pH=10.
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质.取0.5L该溶液先加入Na2CO3(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(0H)3,同时KMnO4转化为MnO2.经检测溶液中Fe2+的浓度为0.009mol•L-1,则该溶液中至少应加入0.0015mol KMnO4.
分析 由实验流程可知,含锌物料为原料,采用硫酸浸出锌,过滤除杂,得到滤液中含锌离子,与加入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌.
(1)Na的焰色为黄色,以此检验;
(2)pH=12的Na2CO3溶液,n(Na)=2n(C),c(OH-)=0.01mol/L,溶液显碱性,结合电荷守恒、物料守恒等分析选项;
(3)Fe2+、Cu2+等杂质,均可与碳酸钠反应;适量KMnO4将Fe2+转化为Fe(OH)3,由电子守恒计算.
解答 解:由实验流程可知,含锌物料为原料,采用硫酸浸出锌,过滤除杂,得到滤液中含锌离子,与加入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌.
(1)Na的焰色为黄色,则检验溶液中含有Na+,常用焰色反应,故答案为:焰色反应;
(2)pH=12的Na2CO3溶液,由化学式可知,n(Na)=2n(C),
A.该溶液中存在电荷守恒为:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故A错误;
B.该溶液中存在电荷守恒,c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),碳酸钠溶液中CO32-水解溶液显碱性,c(CO32-)>c(HCO3-),则c(Na+)+c(H+)>c(CO32-)+2c(HCO3-)+c(OH-)正确,故B正确;
C.该溶液中存在物料守恒n(Na)=2n(C):c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故C正确;
D.若将该溶液稀释至100倍,水解平衡正向进行,氢氧根离子浓度减小小于100倍,则pH>10,故D错误;
故答案为:BC;
(3)溶解后得到酸性溶液,要调节溶液的pH至5.4,需要升高pH,故应加入Na2CO3,Fe2+的浓度为0.009mol•L-1,则
n(Fe2+)=0.009 mol/L×0.5L=0.0045mol,由电子得失守恒,则n(KMnO4)=$\frac{0.0045mol}{7-4}$=0.0015 mol,故答案为:Na2CO3;0.0015.
点评 本题考查学生对工艺流程的理解、阅读获取信息能力、对操作步骤的分析评价、物质的分离提纯、氧化还原反应计算等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力,题目难度中等.

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案| A. | 若增大压强,则混合气体的平均分子量减小 | |
| B. | 将容器体积变为0.5 L,Z的平衡浓度变为原来的2倍 | |
| C. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| D. | 保持体积不变,向其中充入1 mol He气体,平衡右移 |
| A. | H2O2→O2的变化过程中,必须要加入合适的氧化剂才能实现 | |
| B. | Al2O3+3C+N2═2AlN+3CO中,Al2O3是氧化剂 | |
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中MnO2是还原剂 | |
| D. | 有金属单质参加的反应中,金属单质一定作还原剂 |
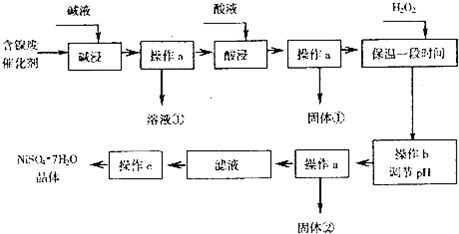
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、漏斗、玻璃棒外还需要的主要仪器为蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑,Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)在40℃左右,用6%的H2O2能氧化Fe2+此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀而把铁除去.图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾钠稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10-39).下列说法正确的是CD(选填序号).
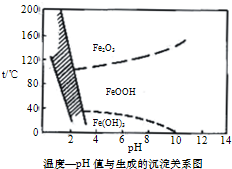
A.FeOOH中铁为+2价
B.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
C.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O
D.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(5)操作b调节pH的范围为3.2-7.1.
(6)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.

(1)①电弧炉中发生的主要反应是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑.
②用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式
为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,碳化硅又称金刚砂,其晶体结构与金刚石相似.
(2)在流化床反应的产物中,SiCl4大约占85%,还有Cl2等,有关物质的沸点数据如下表:
| 物质 | Si | SiCl4 | Cl2 |
| 沸点/℃ | 2355 | 57.6 | -34.1 |
A.略小于-34.1℃B.大于57.6℃C.略小于57.6℃D.-34.1℃
(3)①粉末状Si3N4遇水能生成一种有刺激性气味、常用做制冷剂的气体和一种难溶性的酸,该反应的方程式是Si3N4+9H2O=4NH3↑+3H2SiO3↓.
②该工艺流程中涉及的主要反应属于氧化还原反应的有2个.
| A. | 同主族金属的原子半径越大,熔点越高 | |
| B. | 分子间作用力越强,分子晶体的熔点越高 | |
| C. | 稀有气体原子序数越大,熔点越低 | |
| D. | 同周期元素的原子半径越小,越易失去电子 |
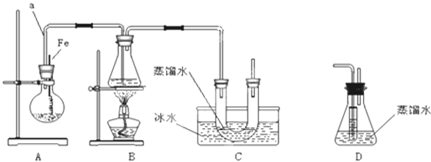
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$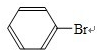 +HBr.
+HBr.