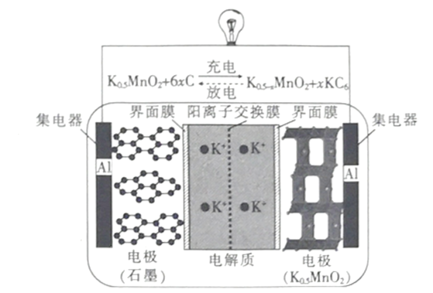
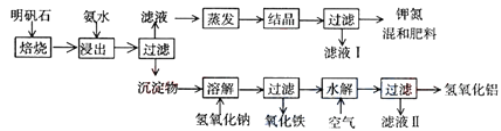
题目内容
【题目】空气中CO2浓度的持续走高引起人们的高度重视。一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2。为此,他们设想了一系列“捕捉”和“封存” CO2的方法。
方法Ⅰ:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如图所示。
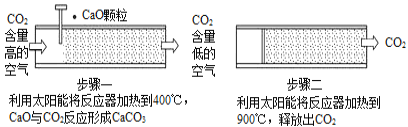
(1)步骤一中的CaO俗称____________。
(2)步骤二中发生反应的化学方程式是____________,该反应____________(填“是”或“不是”)步骤一中反应的逆反应。
方法Ⅱ:另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图所示。
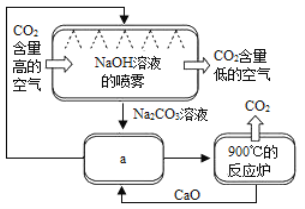
(1)NaOH溶液喷成雾状是为了_________________。
(2)上图a环节中,物质分离的基本操作是__________。
(3)为了尽量减少成本,在整个流程中,循环利用的物质有CaO和____________。
(4)下列溶液中,同样能用于“捕捉”二氧化碳的是____________。
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
(5)“捕捉”到的二氧化碳,一部分可以用于生产;一部分则设想注入深海中“封存”起来。但过多的二氧化碳会导致海水水质的变化,最终殃及海洋生物,其原因是_____(用化学方程式表示)。
【答案】生石灰 CaCO3![]() CaO+CO2 不是 增大反应物的接触面积(或提高反应速率;或提高吸收效率;或充分反应;或更好地、有效地吸收) 过滤 NaOH D CO2+H2O
CaO+CO2 不是 增大反应物的接触面积(或提高反应速率;或提高吸收效率;或充分反应;或更好地、有效地吸收) 过滤 NaOH D CO2+H2O![]() H2CO3或H2CO3
H2CO3或H2CO3![]() H++HCO3-
H++HCO3-
【解析】
方法Ⅰ:(1)CaO是生石灰的俗称。
(2)步骤二中发生碳酸钙的分解反应,该反应与步骤一中反应的温度分别为400℃和900℃。
方法Ⅱ:(1)NaOH溶液吸收二氧化碳气体时,只有相接触才能发生反应,喷成雾状是为了二者接触的充分。
(2)a环节中,是固体与液体物质发生分离。
(3)在整个流程中,循环利用的物质有CaO和氢氧化钠。
(4)能用于“捕捉”二氧化碳的是溶液应能与CO2反应。
(5)过多的二氧化碳会导致海水水质的变化,最终殃及海洋生物,其原因是二氧化碳溶于水后产生影响海洋生物生存环境的物质。
方法Ⅰ:(1)CaO俗称生石灰。答案为:生石灰;
(2)步骤二中发生碳酸钙的分解反应,方程式为CaCO3![]() CaO+CO2↑,该反应与步骤一中反应的温度不同,所以该反应不是步骤一中反应的逆反应。答案为:CaCO3
CaO+CO2↑,该反应与步骤一中反应的温度不同,所以该反应不是步骤一中反应的逆反应。答案为:CaCO3![]() CaO+CO2↑;不是;
CaO+CO2↑;不是;
方法Ⅱ:(1)NaOH溶液吸收二氧化碳气体时,只有相接触才能发生反应,喷成雾状是为了增大反应物的接触面积(或提高反应速率;或提高吸收效率;或充分反应;或更好地、有效地吸收)。答案为:增大反应物的接触面积(或提高反应速率;或提高吸收效率;或充分反应;或更好地、有效地吸收);
(2)a环节中,物质分离的基本操作是过滤。答案为:过滤;
(3)吸收CO2时发生反应CO2+2NaOH=Na2CO3+H2O,Na2CO3溶液中加入CaO后发生的反应为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,则在整个流程中,循环利用的物质有CaO和NaOH。答案为:NaOH;
(4)KNO3溶液、CaCl2溶液、CuSO4溶液与二氧化碳都不反应,只有Na2CO3溶液能吸收二氧化碳,发生反应为CO2+2NaOH=Na2CO3+H2O,所以能用于“捕捉”二氧化碳的是D。答案为:D;
(5)过多的二氧化碳会导致海水水质的变化,最终殃及海洋生物,其原因是二氧化碳溶于水后产生影响海洋生物生存环境的物质,反应方程式为CO2+H2O![]() H2CO3或H2CO3
H2CO3或H2CO3![]() H++HCO3-。答案为:CO2+H2O
H++HCO3-。答案为:CO2+H2O![]() H2CO3或H2CO3
H2CO3或H2CO3![]() H++HCO3-。
H++HCO3-。

 应用题作业本系列答案
应用题作业本系列答案【题目】2019年10月27日,国际清洁能源会议(ICCE2019)在北京开幕。一碳化学成为这次会议的重要议程。甲醇、甲醛(HCHO) 等一碳化合物在化工 、医药,能源等方面都有着广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成 1mol HCHO过程中能量变化如图1。

已知:CO2(g)+3H2(g)=CH3OH(g) +H2O(g) △H=-49.5kJ mo1-1,则反应CO2(g)+2H2(g)= HCHO(g) +H2O(g) △H= ___________kJ mo1-1。
(2)氧化剂可处理甲醛污染,结合图2分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为__________(填化学式)。

(3)纳米二氧化钛催化剂可用于工业上合成甲醇,CO2(g)+2H2(g)![]() CH3OH(g) △H=akJmo1-1
CH3OH(g) △H=akJmo1-1
①按![]() =2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a _____(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是__________________。
=2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a _____(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是__________________。

②在温度为T1℃,向某恒容密闭容器中充入 H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0 mo1L-1。达到平衡时,CO的转化率为图3中的 M 点对应的转化率,则在该温度下,对应的N 点的平衡常数为__________(保留3 位有效数字)。
(4)工业上利用CH4(CO和H2)与水蒸气在一定条件下制取 H2:CH4(g) +H2O(g)![]() CO(g)+3H2(g) △H=+203kJmo1-1,该中反应的逆反应速率及表达式为v逆=kc(CO)c3(H2),k 为速率常数,在某温度下测得实验数据如表所示,
CO(g)+3H2(g) △H=+203kJmo1-1,该中反应的逆反应速率及表达式为v逆=kc(CO)c3(H2),k 为速率常数,在某温度下测得实验数据如表所示,
CO浓度(mo1L-1) | H2浓度(mo1L-1) | 逆反应速率(mo1L-1min-1) |
0.1 | c1 | 8.0 |
c2 | c1 | 16.0 |
c2 | 0.15 | 6.75 |
由上还数据可得该温度下,c2=____________,该反应的逆反应速率常数 k=______L3mo1-3min-1)。