题目内容
【题目】2019年10月27日,国际清洁能源会议(ICCE2019)在北京开幕。一碳化学成为这次会议的重要议程。甲醇、甲醛(HCHO) 等一碳化合物在化工 、医药,能源等方面都有着广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成 1mol HCHO过程中能量变化如图1。
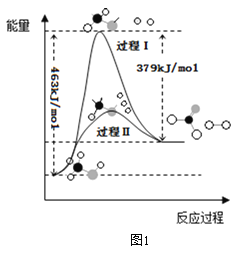
已知:CO2(g)+3H2(g)=CH3OH(g) +H2O(g) △H=-49.5kJ mo1-1,则反应CO2(g)+2H2(g)= HCHO(g) +H2O(g) △H= ___________kJ mo1-1。
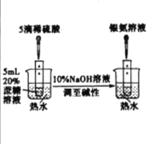
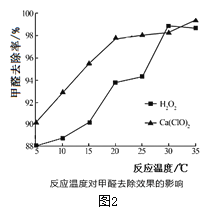
(2)氧化剂可处理甲醛污染,结合图2分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为__________(填化学式)。
(3)纳米二氧化钛催化剂可用于工业上合成甲醇,CO2(g)+2H2(g)![]() CH3OH(g) △H=akJmo1-1
CH3OH(g) △H=akJmo1-1
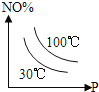
①按![]() =2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a _____(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是__________________。
=2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a _____(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是__________________。
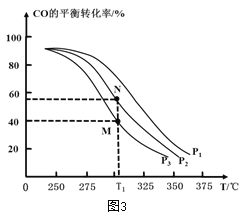
②在温度为T1℃,向某恒容密闭容器中充入 H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0 mo1L-1。达到平衡时,CO的转化率为图3中的 M 点对应的转化率,则在该温度下,对应的N 点的平衡常数为__________(保留3 位有效数字)。
(4)工业上利用CH4(CO和H2)与水蒸气在一定条件下制取 H2:CH4(g) +H2O(g)![]() CO(g)+3H2(g) △H=+203kJmo1-1,该中反应的逆反应速率及表达式为v逆=kc(CO)c3(H2),k 为速率常数,在某温度下测得实验数据如表所示,
CO(g)+3H2(g) △H=+203kJmo1-1,该中反应的逆反应速率及表达式为v逆=kc(CO)c3(H2),k 为速率常数,在某温度下测得实验数据如表所示,
CO浓度(mo1L-1) | H2浓度(mo1L-1) | 逆反应速率(mo1L-1min-1) |
0.1 | c1 | 8.0 |
c2 | c1 | 16.0 |
c2 | 0.15 | 6.75 |
由上还数据可得该温度下,c2=____________,该反应的逆反应速率常数 k=______L3mo1-3min-1)。
【答案】+34.5 Ca(ClO)2 < p3<p2<p1 4.17 0.2 1.0×104
【解析】
(1)已知:①CO2(g)+3H2(g)=CH3OH(g) +H2O(g) △H=-49.5kJ mo1-1,由图1可知②CH3OH(g)=HCHO(g)+H2(g)△H=+(463-379)kJ·mol-1=+84kJ·mol-1,根据盖斯定律①+②,则反应CO2(g)+2H2(g)= HCHO(g) +H2O(g) △H=+34.5kJmo1-1,故答案为:+34.5;
(2)氧化剂可处理甲醛污染,结合图 2,水温约为15℃时,选择Ca(ClO)2处理被甲醛污染的水源时,甲醛去除率更高,故答案为:Ca(ClO)2;
(3)①由图3可知,随着温度升高,CO的平衡转化率逐渐下降,说明平衡逆向移动,则△H<0,故a<0;该反应是气体分子数减小的反应,增大压强,平衡正向移动,CO的平衡转化率增大,则p3<p2<p1;故答案为:<;p3<p2<p1;
②起始时c(H2)=c(CO)=2.0mol·L-1,达到平衡时,CO的转化率为40%,

K=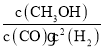 =
=![]() =4.17,故答案为:4.17;
=4.17,故答案为:4.17;
(4)v逆=kc(CO)c3(H2),则c13=![]() ,c2=
,c2=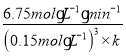 ,根据表中数据v逆=kc(CO)c3(H2)=k×
,根据表中数据v逆=kc(CO)c3(H2)=k×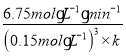 ×
×![]() =16.0mol·L-1·min-1,解得k=1.0×104L3mo1-3min-1;c2=
=16.0mol·L-1·min-1,解得k=1.0×104L3mo1-3min-1;c2=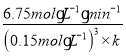 =0.2mol·L-1。故答案为:0.2;1.0×104。
=0.2mol·L-1。故答案为:0.2;1.0×104。

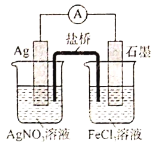
【题目】依据信息写出下列反应的方程式或填充合适的物质。
⑴氢氧化铟[In(OH)3]广泛应用于电子行业。以氧化铟废渣(主要含In2O3和Fe3O4)为原料制备氢氧化铟的一种工艺流程如下:
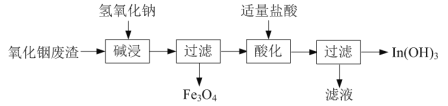
已知:In2O3为两性氧化物,在强碱性条件下In元素以InO33-离子形式存在。
①写出“碱浸”时反应的离子方程式:______。
②写出“酸化”时反应的离子方程式:______。
⑵下表所示为部分酸的电离平衡常数:
酸 | H2SO3 | CH3COOH | HCOOH |
电离平衡常数 | Ka1=1.2×10-2 Ka2=5.6×10-8 | 1.75×10-5 | 1.8×10-4 |
从H2SO3、CH3COOH中选择合适的物质,以实现HCOONa→HCOOH的转化,写出该反应的离子方程式:______。
⑶下表所示为部分物质的溶度积常数:
难溶物 | Mn(OH)2 | Co(OH)2 | MnCO3 |
溶度积常数 | 2×10-13 | 5.9×10-15 | 2.2×10-11 |
①从NaOH、Co(OH)2中选取合适的物质,填在如下转化关系中:MnCl2→Mn(OH)2。______
②NaNO3、Na2CO3中选择合适的物质,填在如下转化关系中:MnCl2→NaCl。_______
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向Fe( NO3)2 与KSCN 组成的混合溶液中滴入少量稀盐酸 | 溶液颜色不变 |
B | 向稀溴水中通入足量 SO2气体 | 溶液的橙色逐渐褪去,最终为无色溶液 |
C | 向新制氯水中加入少量石灰石 | 溶液的浅黄绿色逐渐褪去 |
D | 将打磨光亮的铝片放置在酒精灯外焰上加热 | 铝片逐渐熔化但不滴落 |
A.AB.BC.CD.D
【题目】(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强 /MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min时,以N2表示的平均反应速率=____;
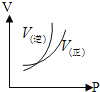
(2)工业合成氨的反应方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH。如图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH。如图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
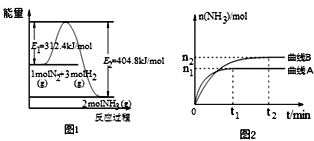
下列说法正确的是(_____)
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的温度越低越好
D.图Ⅱ是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
E.图Ⅱ是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB
F.该反应的平衡常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为n1/(4t1) mol/(L.min)
(3)一定温度下,向一个容积为2L的密闭容器中通入2molN2和7molH2,达到平衡时测得容器内的压强为起始时的7/9倍,则此温度下的平衡常数为___。在同一温度,同一容器中,将起始物质改为amolN2,bmolH2和cmolNH3(a、b、c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a、b、c满足的关系为____(用含a、b、c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是____。