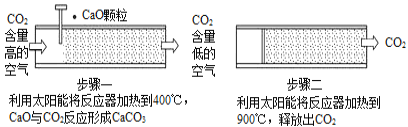
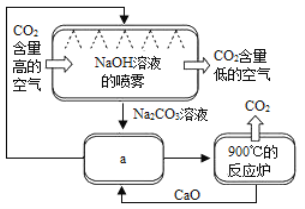
题目内容
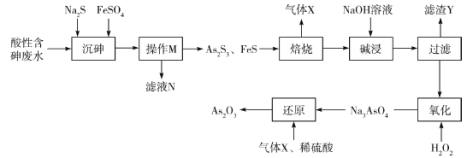
【题目】三氧化二砷(As2O3)可用于治疗急性早幼粒白血病。利用某酸性含砷废水(含![]() 、H+、
、H+、![]() )可提取三氧化二砷,提取工艺流程如下:
)可提取三氧化二砷,提取工艺流程如下:
已知:①常温下,![]() ;
;![]() 。
。
②As2O3+6NaOH=2Na3AsO3+3H2O。
③As2S3易溶于过量的Na2S溶液中,故加入FeSO4的目的是除去过量的S2-。
回答下列问题:
(1)操作M的名称是________,滤液N中含有的阳离子有Fe2+、H+、________。
(2)“焙烧”操作中,As2S3参与反应的化学方程式为____________。
(3)“碱浸”的目的是_____________,“滤渣Y”的主要成分是_____________(写化学式)。
(4)“氧化”中发生反应的离子方程式为___________________。
(5)该流程中可循环使用的物质是_________(写化学式),某次“还原”过程中制得了1.98kgAs2O3,则消耗标准状况下该物质的体积是________L。
(6)溶液中金属离子的除去方法之一是Na2S沉降法。常温下,若某溶液中含Fe2+、Ag+,且浓度均为0.1mol·L-1,则向该溶液中滴加稀Na2S溶液时,先生成的沉淀是________(填化学式)。
【答案】过滤 Na+ 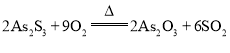 从As2O3和Fe2O3的混合物中分离出As元素 Fe2O3
从As2O3和Fe2O3的混合物中分离出As元素 Fe2O3 ![]() SO2 448 Ag2S
SO2 448 Ag2S
【解析】
酸性含砷废水(含![]() 、H+、
、H+、![]() )加入Na2S和FeSO4得到As2S3和FeS沉淀,过滤将沉淀和滤液分离;As2S3和FeS在空气中焙烧得到As2O3、Fe2O3以及SO2,加入NaOH溶液溶解焙烧产物,As2O3反应生成Na3AsO3形成溶液,过滤得到的滤渣Y为Fe2O3,加入双氧水将Na3AsO3氧化得到Na3AsO4,通入二氧化硫和稀硫酸将Na3AsO4还原得到As2O3。
)加入Na2S和FeSO4得到As2S3和FeS沉淀,过滤将沉淀和滤液分离;As2S3和FeS在空气中焙烧得到As2O3、Fe2O3以及SO2,加入NaOH溶液溶解焙烧产物,As2O3反应生成Na3AsO3形成溶液,过滤得到的滤渣Y为Fe2O3,加入双氧水将Na3AsO3氧化得到Na3AsO4,通入二氧化硫和稀硫酸将Na3AsO4还原得到As2O3。
(1)将固体和液体分离可以采用过滤的方法;沉砷时加入了硫化钠和硫酸亚铁,所以阳离子除了Fe2+、H+还有Na+;
(2)焙烧过程中As2S3中S元素被空气中的氧气氧化为SO2,结合元素守恒和电子守恒可得反应方程式为![]() ;
;
(3)根据题目所给信息可知As2O3可以和NaOH溶液发生反应,而Fe2O3不能,所以碱浸的目的是从As2O3和Fe2O3的混合物中分离出As元素;滤渣Y为Fe2O3;
(4)氧化过程中![]() 被双氧水氧化成
被双氧水氧化成![]() ,结合电子守恒和电荷守恒可得离子方程式为
,结合电子守恒和电荷守恒可得离子方程式为![]() ;
;
(5)焙烧过程产生二氧化硫,二氧化硫具有还原性,还原时可用二氧化硫还原Na3AsO4,所以可以循环使用的物质为SO2;1.98kgAs2O3的物质的量为![]() =10mol,还原过程中As元素由+5价变为+2价,所以生成10mol产品转移40mol电子,S元素由+4(SO2)价变为+6(SO
=10mol,还原过程中As元素由+5价变为+2价,所以生成10mol产品转移40mol电子,S元素由+4(SO2)价变为+6(SO![]() )价,所以转移40mol电子时需要消耗20mol二氧化硫,标况下体积为448L;
)价,所以转移40mol电子时需要消耗20mol二氧化硫,标况下体积为448L;
(6)常温下,![]() ;
;![]() ,虽然两种沉淀类型不同,但硫化银的溶度积比硫化亚铁的溶度积小得多,所以可断定硫化银更难溶,所以相同情况下,先生成的沉淀为Ag2S。
,虽然两种沉淀类型不同,但硫化银的溶度积比硫化亚铁的溶度积小得多,所以可断定硫化银更难溶,所以相同情况下,先生成的沉淀为Ag2S。

 阅读快车系列答案
阅读快车系列答案【题目】50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
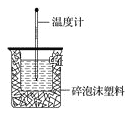
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______________,烧杯间填满碎泡沫塑料的作用是_________________。
(2)向盐酸中倒入NaOH溶液的正确操作是:________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)大烧杯上如果不盖硬纸板,则求得的中和热 ________(填“偏大”、“偏小”或“无影响”)。
(4)两次实验记录的数据如下表:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.3℃ | |
② | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.4℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ/(℃·kg),各溶液的密度均为1g/cm3。则中和热ΔH=_________kJ·mol-1。
(5)若改用60mL 0.50mol·L-1 盐酸和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)。