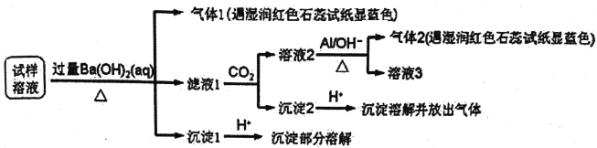
题目内容
【题目】某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g。再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是 。若蒸发皿质量是 W1 g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。有同学提出,还可以采用以下方法来测定:
①溶解样品改用了硫酸,而不用盐酸,为什么 。

②选择的还原剂是否能用铁 (填“是”或“否”),原因是: 。
③若滴定用掉c mol/ L KMnO4溶液bmL,则样品中铁元素的质量分数是 。
【答案】
(1)250mL容量瓶;胶头滴管 ;
(2)2Fe2+ +Br2===2Fe3+ +2Br- ;
(3) 再次加热冷却并称量,直至两次质量差小于0.1g ;![]() ×100% ;
×100% ;
①过量的盐酸对后面KMnO4的滴定有干扰 ;
②否;如果用铁做还原剂,Fe+2Fe3+=3Fe2+,且Fe会与过量的硫酸反应生成Fe2+,干扰铁元素的测定;
③![]() ×100%
×100%
【解析】
试题分析:
(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;故答案为:250mL容量瓶;胶头滴管;
(2)因Br2具有氧化性,能氧化Fe2+:2Fe2++Br2=2Fe3++2Br-;为了使Fe3+充分沉淀,氨水要过量;
(3)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g;
因铁元素质量守恒,即红棕色固体Fe2O3中的铁就是样品中铁,Fe2O3中铁元素的质量为(W2-W1)g×![]() ;样品中铁元素的质量分数是
;样品中铁元素的质量分数是![]() ×100%=
×100%=![]() ×100%;
×100%;
①高锰酸钾具有强氧化性,加入盐酸,溶液中的氯离子会被氧化,多消耗高锰酸钾,产生实验测定误差;②还原剂不能用铁,因为有铁会和过量硫酸反应生成硫酸亚铁,再用高锰酸钾滴定,多消耗氧化剂产生误差,干扰原混合物的铁元素的测定;
③依据反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;依据定量关系计算得到:
设铁元素质量分数为X%,
5Fe2+ ~ 5Fe3+ ~ KMnO4
5×56 1
a×X%×![]() c×b×10-3
c×b×10-3
铁元素的质量分数是X%=![]() ,故答案为:
,故答案为:![]() 。
。

 学而优衔接教材南京大学出版社系列答案
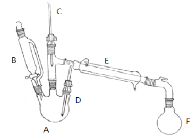
学而优衔接教材南京大学出版社系列答案【题目】实验室制取溴乙烷的主反应如下:

副反应:在该实验中经常会有乙醚、溴等副产物生成,装置如图所示。
相对分子质量 | 密度/(g·cm—3) | 沸点/℃ | 溶解度 | |
乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
实验步骤:
①向A中先加入5 mL 95%的无水乙醇(0.085 mol)和4.5 mL的水,加入溴化钠7.725 g ,再加入沸石,摇匀。在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中。
②在B中加入9.5 mL浓硫酸(0.17 mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2 mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加入沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g。
回答问题:
(1)仪器E的名称为 ;反应装置中有使用C、D两根温度计,其中D温度计的作用是: 。
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是 。饱和亚硫酸氢钠溶液的作用是 ;
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有 (填标号)。
A.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 D.减少因浓硫酸氧化HBr而生成副产物溴;
(4)步骤③中分出馏出液中有机层的操作名称为 。加入浓硫酸除杂后的溶液明显分层,粗产物在 层(填“上”或“下”);
(5)本实验的产率为 。