题目内容
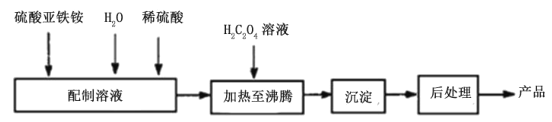
【题目】[化学—选修22:化学生活与技术]氯碱工业过程中产生了大量的盐泥。某氯碱工厂的盐泥组成如下:
成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | SiO2等不溶于酸的物质 |
质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
该工厂进一步利用盐泥生产了七水硫酸镁,设计了工艺流程如图:

回答下列问题:
(1)反应器中加入酸溶解,反应液控制pH为5左右,反应温度在50℃左右,写出有关化学反应方程式 。
(2)在滤饼中检测到硫酸钙的成分,其原因是 。
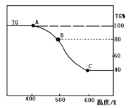
(3)已知一些盐的溶解度如下图。在滤液I中通入高温水蒸气进行蒸发结晶,为了析出晶体I,应控制温度在__________℃。

(4)步骤II操作是_______________,
(5)步骤III在工业上常用的设备是______________(填字母)。
A.加压干燥器 B.蒸馏塔 C.离心机 D.真空干燥器
(6)准确称取制备产品ag,将其加入到盛有V1mL c1mol/L的NaOH溶液的锥形瓶中,溶解后,加入酚酞溶液2滴,溶液变红色,再用c2mol/L的盐酸进行滴定,消耗盐酸V2mL,则样品MgSO4·7H2O的质量分数是 。
【答案】(1)Mg(OH)2+H2SO4===MgSO4+2H2O;CaCO3+H2SO4![]() CaSO4+H2O+CO2↑(2分)。
CaSO4+H2O+CO2↑(2分)。
(2)因为CaCO3+H2SO4![]() CaSO4+H2CO3,加热有H2CO3
CaSO4+H2CO3,加热有H2CO3![]() H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4(3分);
H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4(3分);
(3)80 (2分);
(4)冷却结晶、洗涤 (2分);
(5)D(2分);
(6)![]() %。(2分)
%。(2分)
【解析】
试题分析:
(1)根据盐泥成分可知,能溶于酸的只有Mg(OH)2和CaCO3两种,又因该流程的目的是制备七水硫酸镁,则加入的酸为硫酸,则反应方程式为:Mg(OH)2+H2SO4===MgSO4+2H2O;CaCO3+H2SO4![]() CaSO4+H2O+CO2↑。
CaSO4+H2O+CO2↑。
(2)因为CaCO3+H2SO4![]() CaSO4+H2CO3,加热有H2CO3
CaSO4+H2CO3,加热有H2CO3![]() H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4,导致在滤饼中检测到硫酸钙的成分。
H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4,导致在滤饼中检测到硫酸钙的成分。
(3)观察溶解度图象,当温度大于80℃,随着温度的升高,氯化镁的溶解度逐渐增大,而硫酸镁的溶解度反而下降,氯化钠的溶解度一直比较低。故在滤液I中通入高温水蒸气进行蒸发结晶析出的晶体为氯化钠,为避免硫酸镁结晶析出,应控制温度在80℃。
(4)步骤II操作是冷却结晶、洗涤。
(5)步骤III在工业上常用的设备是真空干燥器。
(6)NaOH溶液总物质的量为c1V1×10-3mol,与盐酸反应的NaOH物质的量为c2V2×10-3mol,则与MgSO4·7H2O反应的NaOH物质的量为(c1V1-c2V2)×10-3mol,可得MgSO4·7H2O的质量为(c1V1-c2V2)×10-3××246 g。则样品MgSO4·7H2O的质量分数是![]() %。
%。

【题目】(1)某科研小组研究:在恒温、恒容(容器容积为2L,)下N2(g)+3H2(g)![]() 2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
①此条件下反应的平衡常数K= 。
②若初始条件n (NH3)= 2mol,反应达到平衡时NH3的转化率为 ,
③若初始条件n (H2)= 6mol 、n (N2) =2mol,反应达到平衡时NH3的体积分数 43%,此时移除0.5 mol NH3 ,再次达到平衡时NH3的体积分数 43% (填 “>、<、=”)
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g),ΔH>0
4NO2(g)+O2(g),ΔH>0
①下表为该反应在T1温度下的部分实验数据
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为 。
②现以NO2、O2、N2O5、熔融盐NaNO3组成的燃料电池,采用电解法制备N2O5,装置如图所示。

写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。