题目内容
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为第 周期、第 族,PbO2的酸性比CO2的酸性 (填“强”“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得反应的离子方程式为 ;Pb O2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的
O2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的 电极反应式为_____________。阴极上观察到的现象是_ _;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _ 。
电极反应式为_____________。阴极上观察到的现象是_ _;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _ 。
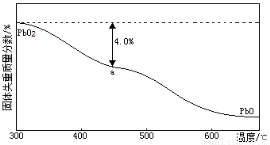
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%( )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_ 。
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_ 。
练习册系列答案
相关题目
5.地窖中二氧化碳的含量达到10%以上,人和动物进入地窖时可导致死亡,这是因为二氧化碳( )
| A. | 有剧毒 | B. | 有腐蚀性 | C. | 不支持燃烧 | D. | 不能供给呼吸 |


 O = HIO + HCl 不属于氧化还原反应
O = HIO + HCl 不属于氧化还原反应 剂
剂 存在的离子是Na+、OH–
存在的离子是Na+、OH– 溶液均显中性
溶液均显中性 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它易溶于水,不溶于醇,受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它易溶于水,不溶于醇,受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.