题目内容
10.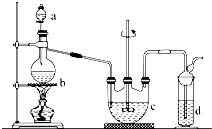 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它易溶于水,不溶于醇,受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它易溶于水,不溶于醇,受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
(1)b中反应的离子方程式为SO32-+2H+═SO2↑+H2O或HSO3-+H+═SO2↑+H2O,c中试剂为硫化钠和碳酸钠混合溶液.
(2)反应开始后,c中先有浑浊产生,后又变澄清.此浑浊物是S.
(3)d中的试剂为氢氧化钠溶液.
(4)实验中要控制SO2生成速率,可以采取的措施有控制反应的温度或硫酸的滴加速度(写出两条).
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是若SO2过量,溶液显酸性,产物分解.
(6)所得产品常含有少量Na2SO3和Na2SO4.为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
①取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4.
②为减少装置C中生成Na2SO4的量,在实验过程中应注意的操作顺序是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液.
分析 (1)第一个装置为二氧化硫的制取装置,制取二氧化硫的原料为亚硫酸钠和70%的浓硫酸,c装置为Na2S2O3的生成装置,根据反应原理可知c中的试剂为:硫化钠和碳酸钠的混合溶液;d装置为尾气吸收装置,吸收二氧化硫和硫化氢等酸性气体;
(2)反应开始时发生的反应为:Na2S+4SO2+H2O=2H2S+Na2SO3,SO2+2H2S=3S↓+2H2O,据此答题;
(3)d装置为尾气吸收装置,吸收二氧化硫和硫化氢等酸性气体,应选用氢氧化钠溶液;
(4)通过控制反应的温度或硫酸的滴加速度可以控制SO2生成速率;
(5)硫代硫酸钠遇酸易分解,若通入的SO2过量,则溶液显酸性,硫代硫酸钠会分解;
(6)①根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4;
②因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液.
解答 解:(1)第一个装置为二氧化硫的制取装置,制取二氧化硫的原料为亚硫酸钠和70%的浓硫酸,反应的离子方程式为:SO32-+2H+═SO2↑+H2O,c装置为Na2S2O3的生成装置,根据反应原理可知c中的试剂为:硫化钠和碳酸钠的混合溶液,
故答案为:SO32-+2H+═SO2↑+H2O或HSO3-+H+═SO2↑+H2O;硫化钠和碳酸钠混合溶液;
(2)反应开始时发生的反应为:Na2S+4SO2+H2O=2H2S+Na2SO3,SO2+2H2S=3S↓+2H2O,故该浑浊物是S,
故答案为:S;
(3)d装置为尾气吸收装置,吸收二氧化硫和硫化氢等酸性气体,应选用氢氧化钠溶液,
故答案为:氢氧化钠溶液;
(4)通过控制反应的温度或硫酸的滴加速度可以控制SO2生成速率,
故答案为:控制反应的温度或硫酸的滴加速度;
(5)硫代硫酸钠遇酸易分解,若通入的SO2过量,则溶液显酸性,硫代硫酸钠会分解,
故答案为:若SO2过量,溶液显酸性,产物分解;
(6)①根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4,
故答案为:过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸;
②因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液,
故答案为:先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液.
点评 本题考查了物质制备实验方案的设计和制备过程分析应用,掌握基础如离子反应方程式、定性检验、除杂,注意积累是解题关键,题目难度中等.

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写可能正确的是
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Na+、Fe3+、Cl-、I- | NaOH溶液 | Fe3++3OH-=Fe(OH)3↓ |
B | Mg2+、HCO | 过量NaOH溶液 | Mg2++HCO H2O+Mg(OH)2↓+CO |
C | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2=CO |
D | Na+、NO | NaHSO4溶液 | SO |

有关氢氧化物沉淀完全的pH见表
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| PH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
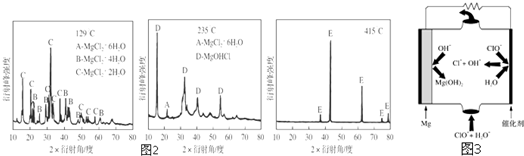
(2)上述工艺多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(3)①在“除杂Ⅰ”中,常用酸性KMnO4溶液,其目的是将Fe2+ 转化成为Fe3+,请写出该反应的离子方程式5Fe2++2MnO4-+16H+=2Mn2++5Fe3++8H2O.将溶液的pH调至4,目的是让三价铁转化为氢氧化铁沉淀而除去.②在“除杂Ⅱ”中,加入锌粉的目的是除去溶液中的Cu2+.
(4)在“碳化合成”中,产物中有碱式碳酸锌[Zn2(OH)2CO3]和CO2等,请写出该反应的化学方程式2Na2CO3+2Zn(NO3)2+H2O=[Zn2(OH)2CO3+CO2+4NaNO3.
| A. | 100 mL 2.0 mol/L 的盐酸与100 mL 2.0 mol/L 的醋酸溶液中氢离子个数均为0.2×6.02×1023 | |
| B. | 每摩尔烷烃(CnH2n+2)含有的共价键数目为(3n+1)×6.02×1023 | |
| C. | 标准状况下,11.2 L四氯化碳所含分子数为0.5×6.02×1023 | |
| D. | 24g镁在足量CO2中燃烧转移的电子数目为4×6.02×1023 |
 O2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的
O2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的 电极反应式为_____________。阴极上观察到的现象是_ _;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _ 。
电极反应式为_____________。阴极上观察到的现象是_ _;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _ 。 )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_ 。
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_ 。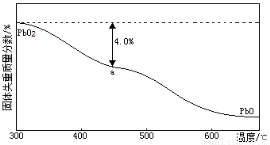
 、Cl-
、Cl-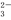
 、SO
、SO