题目内容
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48 L HF,则转移0.8 mol电子
D.还原剂与氧化剂的物质的量之比为1:4
练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
17.下列过程不属于缓慢氧化的是( )
| A. | 呼吸作用 | B. | 钢铁生锈 | C. | 雷电引起火灾 | D. | 食物腐烂 |
15.下列有关物质检验的实验结论错误的是( )
| 选项 | 实验操作 | 现象 | 实验结论 |
| A | 向某溶液中加入硝酸酸化的氯化钡溶液 | 生成白色沉淀 | 溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 将某无色无味的气体通入澄清石灰水中 | 生成白色沉淀 | 该气体一定是CO2 |
| C | 往某溶液中加入AgN03溶液 | 生成白色沉淀 | 溶液中一定含有Cl- |
| D | 往某溶液中加入KSCN溶液 | 溶液呈血红色 | 溶液中一定含有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写可能正确的是
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Na+、Fe3+、Cl-、I- | NaOH溶液 | Fe3++3OH-=Fe(OH)3↓ |
B | Mg2+、HCO | 过量NaOH溶液 | Mg2++HCO H2O+Mg(OH)2↓+CO |
C | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2=CO |
D | Na+、NO | NaHSO4溶液 | SO |
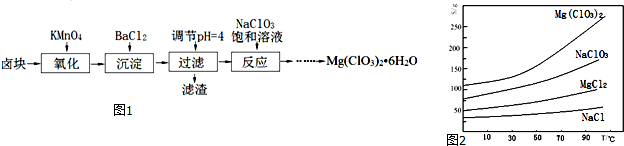
5.氧化锌粉末广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃等行业,为综合应用资源,常从冶炼锌、锌制品加工企业回收的锌渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如图:

有关氢氧化物沉淀完全的pH见表
(1)在酸浸过程中,常将锌渣碎成粉末的目的是增大接触面积,提高锌的浸出速率.
(2)上述工艺多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(3)①在“除杂Ⅰ”中,常用酸性KMnO4溶液,其目的是将Fe2+ 转化成为Fe3+,请写出该反应的离子方程式5Fe2++2MnO4-+16H+=2Mn2++5Fe3++8H2O.将溶液的pH调至4,目的是让三价铁转化为氢氧化铁沉淀而除去.②在“除杂Ⅱ”中,加入锌粉的目的是除去溶液中的Cu2+.
(4)在“碳化合成”中,产物中有碱式碳酸锌[Zn2(OH)2CO3]和CO2等,请写出该反应的化学方程式2Na2CO3+2Zn(NO3)2+H2O=[Zn2(OH)2CO3+CO2+4NaNO3.

有关氢氧化物沉淀完全的pH见表
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| PH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
(2)上述工艺多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(3)①在“除杂Ⅰ”中,常用酸性KMnO4溶液,其目的是将Fe2+ 转化成为Fe3+,请写出该反应的离子方程式5Fe2++2MnO4-+16H+=2Mn2++5Fe3++8H2O.将溶液的pH调至4,目的是让三价铁转化为氢氧化铁沉淀而除去.②在“除杂Ⅱ”中,加入锌粉的目的是除去溶液中的Cu2+.
(4)在“碳化合成”中,产物中有碱式碳酸锌[Zn2(OH)2CO3]和CO2等,请写出该反应的化学方程式2Na2CO3+2Zn(NO3)2+H2O=[Zn2(OH)2CO3+CO2+4NaNO3.
3.下列各物质中含氧原子个数最多的是( )
| A. | 1mol KClO3 | B. | 0.5mol H3PO4 | C. | 1mol O2 | D. | 3.01×1023个CO2 |


 O2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的
O2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的 电极反应式为_____________。阴极上观察到的现象是_ _;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _ 。
电极反应式为_____________。阴极上观察到的现象是_ _;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _ 。 )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_ 。
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_ 。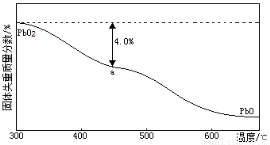
 、Cl-
、Cl-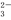
 、SO
、SO