题目内容
11.计算填空(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
aA (g)+bB (g)?2C(g)
起始物质的量(mol):3 2 0
2s末物质的量浓度(mol/L):0.9 0.8 0.4
则①a=3,b=1;
②2s内B的反应速率=0.1mol/(L•s).
(2)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求:
③有1.806×1023个电子通过了电线?(NA=6.02×1023)
④此时溶液中H+的物质的量浓度为1.5mol/L(不考虑溶液体积变化).
(3)将2.3g金属钠放入足量的mg重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是$\frac{4.1}{m+2.1}$×100%(用含m的代数式表示).
分析 (1)①物质的量变化量之比等于化学计量数之比;
②根据v=$\frac{△c}{△t}$计算v(B);
(2)电池反应式为:Fe+H2SO4=FeSO4+H2↑,根据n=$\frac{V}{{V}_{m}}$计算氢气物质的量,转移电子物质的量为氢气的2倍,再根据N=nNA计算转移电子数目;根据H原子守恒计算溶液中H+的物质的量浓度;
(3)发生反应:2Na+2D2O=2NaOD+D2↑,根据方程式计算生成NaOD、D2的质量,溶液质量=Na的质量+水的质量-D2的质量,进而计算溶液质量分数.
解答 解:(1)①物质的量变化量之比等于化学计量数之比,则a:b:2=(3-0.9×2):(2-0.8×2):0.4×2=3:1:2,故a=3,b=1,故答案为:3;1;
②2s内B的反应速率=$\frac{\frac{2mol}{2L}-0.8mol/L}{2s}$=0.1mol/(L•s),故答案为:0.1mol/(L•s);
根据v=$\frac{△c}{△t}$计算v(B);
(2)③电池反应式为:Fe+H2SO4=FeSO4+H2↑,生成氢气物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,转移电子数目为0.15mol×2×6.02×1023mol-1=1.806×1023,故答案为:1.806×1023;
④根据H原子守恒,溶液中H+的物质的量浓度为2×1.5mol/L-$\frac{0.15mol×2}{0.2L}$=1.5mol/L,故答案为:1.5mol/L;
(3)设NaOD的质量为x,D2的质量为y,则:
2Na+2D2O=2NaOD+D2↑
2×23 2×41 4
2.3g x y
x=.$\frac{2.3g×2×41}{2×23}$=4.1g
y=$\frac{2.3g×4}{2×23}$=0.2g
故溶液质量为mg+2.3g-0.2g=(m+2.1)g
溶液质量分数为$\frac{4.1g}{(m+2.1)g}$×100%=$\frac{4.1}{m+2.1}$×100%,
故答案为:$\frac{4.1}{m+2.1}$×100%.
点评 本题考查化学平衡计算、原电池计算、化学方程式计算,侧重考查学生分析计算能力,明确各个物理量关系是解本题关键,注意对基础知识的理解掌握.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 2.5 mol | B. | 4.5 mol | C. | 5mol | D. | 7.5 mol |
| A. | 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 | |
| B. | 降低温度,正反应速率减小,而逆反应速率增大 | |
| C. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980 g | |
| D. | 达到平衡时,SO2的转化率是90% |
| A. | 1mol KClO3 | B. | 0.5mol H3PO4 | C. | 1mol O2 | D. | 3.01×1023个CO2 |
| A. | 100 mL 2.0 mol/L 的盐酸与100 mL 2.0 mol/L 的醋酸溶液中氢离子个数均为0.2×6.02×1023 | |
| B. | 每摩尔烷烃(CnH2n+2)含有的共价键数目为(3n+1)×6.02×1023 | |
| C. | 标准状况下,11.2 L四氯化碳所含分子数为0.5×6.02×1023 | |
| D. | 24g镁在足量CO2中燃烧转移的电子数目为4×6.02×1023 |
| A. | 容量瓶和量筒上均标有温度,且量筒和容量瓶均无“0”刻度 | |
| B. | 用丁达尔现象可鉴别蛋白质溶液、葡萄糖溶液和淀粉溶液 | |
| C. | 用洁净玻璃棒蘸取少量溶液,放在酒精灯上灼烧,透过蓝色钴玻璃观察K的焰色 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
 O2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的
O2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的 电极反应式为_____________。阴极上观察到的现象是_ _;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _ 。
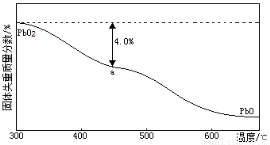
电极反应式为_____________。阴极上观察到的现象是_ _;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _ 。 )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_ 。
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_ 。