题目内容
9.关于化学键的各种叙述中,下列说法中正确的是( )| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 共价化合物里,一定不存在离子键 | |
| C. | 由多种非金属元素组成的化合物一定是共价化合物 | |
| D. | 由不同种元素组成的多原子分子里,一定只存在极性键 |
分析 A.含有金属元素的化合物,可能为共价化合物;
B.含离子键的一定为离子化合物;
C.由多种非金属元素组成的化合物,可能为离子化合物;
D.由不同种元素组成的多原子分子中可存在极性键和非极性键.
解答 解:A.含有金属元素的化合物,可能为共价化合物,如氯化铝为共价化合物,故A错误;
B.含离子键的一定为离子化合物,则共价化合物里一定不存在离子键,故B正确;
C.由多种非金属元素组成的化合物,可能为离子化合物,如铵盐为离子化合物,故C错误;
D.由不同种元素组成的多原子分子中可存在极性键和非极性键,如H-O-O-H中存在极性键和非极性键,故D错误;
故选B.
点评 本题考查化学键及常见物质中的化学键,为高频考点,把握化学键的形成及物质中化学键的判断等为解答的关键,侧重分析与应用能力的考查,注意利用实例分析,题目难度不大.

练习册系列答案
相关题目
19.下列说法错误的是( )
| A. | 煤的气化、液化和干馏都属于化学变化 | |
| B. | 石油的裂化可以提高轻质油的产量和质量 | |
| C. | 石油分馏可获得乙烯、丙烯 | |
| D. | 苯等有机物是从煤干馏产物中分离出来的 |
20.能用于鉴别甲烷和乙烯的试剂是( )
| A. | 盐酸 | B. | 酸性高锰酸钾溶液 | ||
| C. | NaOH溶液 | D. | CCl4 |
17.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 1 mol的氢氧根离子所含电子数均为9 NA | |
| B. | 1.00 mol NaCl中含有NA个NaCl分子 | |
| C. | 常温常压下,92g的NO2和N2O4的混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA |
4.卤代烃能发生下列反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr.下列有机物中,可合成环烷烃的是( )
| A. | CH3CH2CH2Br | B. | CH3CH2CHBr2 | C. | CH2BrCH2CH2Br | D. | CH3CHBrCH2CH2Br |
14.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是( )
| A. | 将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 | |
| B. | 将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 | |
| C. | 在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 | |
| D. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
1.下列化合物中,含有非极性共价键的离子化合物是( )
| A. | NH4NO3 | B. | CaF2 | C. | Na2S2 | D. | Na3N |
1.如图所示能够组成原电池,并且产生明显的电流的是( )
| A. |  | B. | 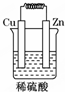 | C. | 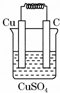 | D. |  |
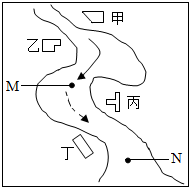 学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现:
学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现: