题目内容
【题目】我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾.检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(1)该反应中氧化剂是(填化学式).
(2)用双线桥表示该反应电子转移的方向和数目.
KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(3)如果反应中转移0.2mol电子,则生成I2的物质的量为 .
(4)利用上述反应检验食盐中是否加碘,所需试剂是(填选项序号).
①碘水 ②KI溶液 ③淀粉溶液 ④稀硫酸 ⑤AgNO3溶液.
【答案】
(1)KIO3
(2)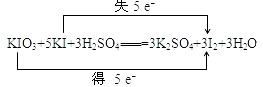
(3)0.12mol
(4)②③④
【解析】解:(1)KIO3中I元素的化合价降低,则KIO3为氧化剂,故答案为:KIO3;
(2.)氧化还原反应KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,化合价升高值=化合价降低值=转移电子数=5e﹣ , 用双线桥表示该反应电子转移的方向和数目为: 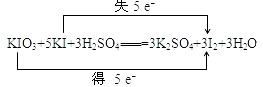 ,
,
故答案为: 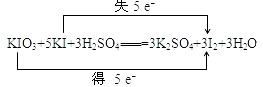 ;
;
(3.)在上述反应中,转移5mol电子生成碘单质的量是3mol,所以如果反应中转移0.2mol电子,则生成I2的物质的量为0.2mol× ![]() =0.12moL,故答案为:0.12mol;
=0.12moL,故答案为:0.12mol;
(4.)食盐中加碘加的是碘酸钾,可以将碘酸根离子转化为碘单质,需要一种还原剂(碘化钾)来实现,再根据碘单质遇到淀粉显示蓝色来检验,在酸性环境下,碘酸根离子和碘离子之间反应生成碘单质,所以选择的试剂有:KI溶液、淀粉溶液、稀硫酸,
故答案为:②③④.
KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由﹣1价升高为0,该反应中转移5e﹣ , 结合淀粉遇碘单质变蓝来解答.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目

