题目内容
3.某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO${\;}_{3}^{-}$的物质的量浓度之比为3:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )| A. | 1:3 | B. | 4:3 | C. | 2:1 | D. | 3:1 |
分析 Cl2生成ClO3-与ClO-是被氧化的过程,Cl2生成KCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO3-与ClO-的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,可计算被还原的氯元素的物质的量,则可计算被氧化的氯元素和被还原的氯元素的物质的量之比
解答 解:Cl2生成ClO3-与ClO-是被氧化的过程,化合价分别由0价升高为+5价和+1价,
ClO-与ClO3-的物质的量浓度之比为3:1,
则可设ClO3-为1mol,ClO-为3mol,被氧化的Cl共为4mol,
失去电子的总物质的量为1mol×(5-0)+3mol×(1-0)=8mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,
则得到电子的物质的量也应为8mol,
则被还原的Cl的物质的量为8mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为8mol:4mol=2:1,
故选C.
点评 本题考查氧化还原反应的计算,题目难度不大,本题注意从氧化还原反应中氧化剂和还原剂之间得失电子数目相等的角度计算,注意守恒法的利用.

练习册系列答案
相关题目
13.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+═2Fe3++2H2O;2Fe3++H2O2═2Fe2++O2↑+2H+.下列说法中,不正确的是( )
| A. | 在H2O2分解过程中,Fe2+是反应的催化剂 | |
| B. | 在H2O2生产过程中,要严格避免混入 Fe2+ | |
| C. | H2O2的氧化性比Fe3+强,还原性比Fe2+强 | |
| D. | 在H2O2分解过程中,溶液的pH逐渐下降 |
14.下列关于有机物的说法不正确的是( )
①C3H6和C2H4的最简式相同且分子量相差14,所以是同系物
②乙二醇和甲醇含有相同的官能团,所以是同系物
③互为同分异构体的化合物不可能具有相同的结构简式
④苯酚、乙酸乙酯、甲醛的沸点逐渐变低.
①C3H6和C2H4的最简式相同且分子量相差14,所以是同系物
②乙二醇和甲醇含有相同的官能团,所以是同系物
③互为同分异构体的化合物不可能具有相同的结构简式
④苯酚、乙酸乙酯、甲醛的沸点逐渐变低.
| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
18.下列电离方程式的书写不正确的是( )
| A. | NH3•H2O═NH$\stackrel{+}{4}$+OH- | B. | BaSO4═Ba2++SO$\stackrel{2-}{4}$ | ||
| C. | HNO3═H++NO$\overline{3}$ | D. | NaOH═Na++OH- |
13.一定温度下,某饱和碳酸钠溶液中碳酸钠的质量分数为ω%,加入a g无水碳酸钠可析出bg碳酸钠晶体(Na2CO3•10H2O),则原溶液中溶质质量减少( )
| A. | (b-a)g | B. | (b-a)×ωg | C. | ($\frac{53b}{143}$-a)g | D. | ($\frac{53b}{143}$-a)×ω%g |
 恒温恒容时,NO2和N2O4之间发生反应N2O4(g)?2NO2(g),如图所示.
恒温恒容时,NO2和N2O4之间发生反应N2O4(g)?2NO2(g),如图所示.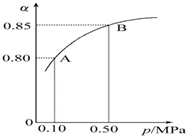 面对全球近期的气候异常,环境问题再次成为焦点.化工厂以及汽车尾气排放的二氧化硫、一氧化碳、氮氧化物(NOx)等气体已成为大气污染的主要因素.
面对全球近期的气候异常,环境问题再次成为焦点.化工厂以及汽车尾气排放的二氧化硫、一氧化碳、氮氧化物(NOx)等气体已成为大气污染的主要因素.