题目内容
12. 面对全球近期的气候异常,环境问题再次成为焦点.化工厂以及汽车尾气排放的二氧化硫、一氧化碳、氮氧化物(NOx)等气体已成为大气污染的主要因素.
面对全球近期的气候异常,环境问题再次成为焦点.化工厂以及汽车尾气排放的二氧化硫、一氧化碳、氮氧化物(NOx)等气体已成为大气污染的主要因素.(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3g).
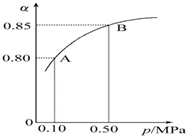
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于800.
②平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”“<”或“=”).
分析 ①反应达平衡后,体系总压强为0.10MPa,由图可知,SO2的平衡转化率α=0.80,利用三段式表示出平衡时反应混合物各组分的物质的量,再计算平衡时反应混合物各组分的平衡浓度,代入平衡常数表达式计算;
②平衡状态由A变到B时,改变的是压强,平衡常数只受温度影响,温度不变,平衡常数不变.
解答 解:①反应达平衡后,体系总压强为0.10MPa,由图可知,SO2的平衡转化率α=0.80,参加反应的二氧化硫为2mol×80%=1.6mol,则:
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)
开始(mol):2 1 0
变化(mol):1.6 0.8 1.6
平衡(mol):0.4 0.2 1.6
所以平衡时浓度:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,故平衡常数k=$\frac{0.1{6}^{2}}{0.0{4}^{2}×0.02}$=800,故答案为:800;
②平衡状态由A变到B时,改变的是压强,平衡常数只受温度影响,温度不变,平衡常数不变,故平衡常数K(A)=K(B),故答案为:=.
点评 本题考查平衡常数的影响因素与计算,难度中等,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO${\;}_{3}^{-}$的物质的量浓度之比为3:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
| A. | 1:3 | B. | 4:3 | C. | 2:1 | D. | 3:1 |
7.环境污染已经成为我国必须面对的首要社会问题.引起下列环境污染的原因或处理方法中正确的是( )
| A. | 雾霾是由大量燃烧煤、天然气、石油等产生的CO2偏高所致 | |
| B. | 绿色化学的核心是开发应用新技术,加大对环境污染的治理能力 | |
| C. | 用催化氧化法处理汽车尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 | |
| D. | 加酶无磷洗衣粉的使用,可以降低水体污染(如海洋的赤潮) |
17.下列有关物质的性质或应用均正确的是( )
| A. | 二氧化硅为酸性氧化物,可用于制作计算机芯片 | |
| B. | 氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂 | |
| C. | 碳酸钠可以作为食品疏松剂 | |
| D. | 食品工业中可以用二氧化硫加工银耳,使之更白 |
4.下列有关化学用语错误的是( )
| A. | 碳酸的二级电离方程式:H2O+HCO3-?H3O++CO32- | |
| B. | 玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为2CaO•5MgO•8SiO2•H2O | |
| C. | NaH与重水反应的方程式:NaH+D2O═NaOD+HD↑ | |
| D. | 均含有NA个电子的H2O和CH4具有相同的体积 |
1.能将Al2(SO4)3、(NH4)2SO4、KCl、MgCl2、FeCl2、Fe2(SO4)3六种溶液鉴别出来的一种试剂是( )
| A. | NaOH溶液 | B. | KSCN溶液 | C. | AgNO3溶液 | D. | BaCl2溶液 |
2.体积相同的HCl、H2SO4、H3PO4被NaOH溶液中和时,消耗相同物质的量浓度的NaOH溶液,体积比依次为3:2:1,则三种酸的物质的量浓度之比为( )
| A. | 3:2:1 | B. | 6:3:2 | C. | 9:3:1 | D. | 12:6:5 |
 FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题: