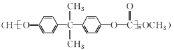
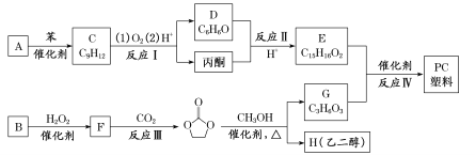
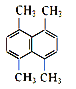
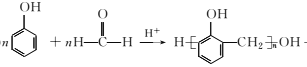��Ŀ����
����Ŀ����һ�����ȼ������ۺ��������Ļ�������������ʵ�飬����һ�����ȼ��м���800ml 2mol/L������������Һ��ʹ���ַ�Ӧ���ռ������������Ϊ20.16L��S��T��P��������һ�ݵ����������ȼ��ڸ����³�ַ�Ӧ����Ӧ������м���2L 2.5mol/L��������Һ��ʹ������ȫ�ܽ⣬��Ӧ����ҺPH=0�������������Һ������䣩��ȡ������Ӧ����Һ���μ����軯�أ�û�г���Ѫ��ɫ��������м��㣺
��1����������ȼ����������������ʵ���֮�ȣ�_______________
��2��ʵ��ڲ��������������Ƕ��٣���S��T��P����______________
���𰸡�2��1 13.44L
��������
��1������������������Һ��Ӧ����n(H2)��![]() ��0.9mol��������������������֮��Ĺ�ϵʽ֪������0.9mol������Ҫn(NaOH)��0.6mol��2.0mol/L��0.8L��1.6mol��˵������ȫ��Ӧ���������������Ĺ�ϵʽ�����������ʵ��������ݵ���غ����n(Fe 2+)���������������ʵ�����
��0.9mol��������������������֮��Ĺ�ϵʽ֪������0.9mol������Ҫn(NaOH)��0.6mol��2.0mol/L��0.8L��1.6mol��˵������ȫ��Ӧ���������������Ĺ�ϵʽ�����������ʵ��������ݵ���غ����n(Fe 2+)���������������ʵ�����
��2�������ݵ���غ����n(Fe 2+)����������������֮��Ĺ�ϵʽ���㷢�����ȷ�Ӧ������еĵ��ʣ��ٽ�ϵ��ʵ����ʵ��������������������
��1������������������Һ��Ӧ����n(H2)��![]() ��0.9mol��������������������֮��Ĺ�ϵʽ֪������0.9mol������Ҫn��NaOH����0.6mol��2.0mol/L��0.8L��1.6mol��˵������ȫ��Ӧ������������Ϊx��
��0.9mol��������������������֮��Ĺ�ϵʽ֪������0.9mol������Ҫn��NaOH����0.6mol��2.0mol/L��0.8L��1.6mol��˵������ȫ��Ӧ������������Ϊx��
2Al+2NaOH+2H2O��2NaAlO2+3H2��
54g 3mol
x 0.9mol
54g��3mol��x��0.9mol
x��![]() ��16.2g
��16.2g
n(Al)��![]() ��0.6mol��
��0.6mol��
�������ȼ����������ʵ���Ϊ0.6mol��
���ݵ���غ��n(H+)+2n(Fe2+)+3n(Al3+)��n(Cl��)��
1mol��2L+2��n(Fe2+)+3��0.6mol��2.5mol/L��2L
n(Fe2+)��![]() ��0.6mol��
��0.6mol��
������ԭ���غ��n(Fe2O3)��![]() n(Fe2+)��0.3mol���������������ʵ���Ϊ0.3mol
n(Fe2+)��0.3mol���������������ʵ���Ϊ0.3mol
�������ߵ����ʵ���֮��Ϊ0.6mol��0.3mol��2��1���ʴ�Ϊ��2��1��
��2����2Al+Fe2O3![]() Al2O3+2Fe���������ȷ�Ӧ����ʽ֪��0.3mol��������ȫ��Ӧ��Ҫn��Al����0.6mol����������ǡ����ȫ��Ӧ��������ԭ���غ��n(Fe)��n(Fe2+)��0.6mol������ת�Ƶ����غ���������������0.6mol��22.4L/mol��13.44L���ʴ�Ϊ��13.44L��
Al2O3+2Fe���������ȷ�Ӧ����ʽ֪��0.3mol��������ȫ��Ӧ��Ҫn��Al����0.6mol����������ǡ����ȫ��Ӧ��������ԭ���غ��n(Fe)��n(Fe2+)��0.6mol������ת�Ƶ����غ���������������0.6mol��22.4L/mol��13.44L���ʴ�Ϊ��13.44L��