题目内容
【题目】向100mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol/L的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。下列说法正确的是( )
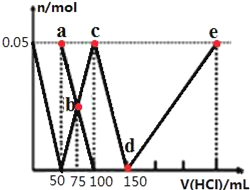
A.原混合溶液中的n(CO32-):n(AlO2-)=1:1
B.a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
C.b点溶液中浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)
D.d→e的过程中水的电离程度逐渐减小
【答案】AC
【解析】
Na2CO3、NaAlO2的混合溶液中逐滴加入1molL﹣1的盐酸:
首先,发生反应AlO2﹣+H++H2O═Al(OH)3↓,最左边曲线表示AlO2﹣,由图可知AlO2﹣反应完毕,加入盐酸50mL,根据方程式可知n(AlO2﹣)=n(H+)=0.05L×1mol/L=0.05mol;
第二阶段,AlO2﹣反应完毕,发生反应CO32﹣+H+═HCO3﹣,ab线表示CO32﹣,bc线表示HCO3﹣,由图可知CO32﹣反应完毕,该阶段加入盐酸100mL﹣50mL=50mL,根据方程式可知n(CO32﹣)=n(H+)=0.05L×1mol/L=0.05mol;
第三阶段,CO32﹣反应完毕,发生反应HCO3﹣+H+═CO2↑+H2O,cd线表示HCO3﹣,由图可知HCO3﹣反应完毕,该阶段加入盐酸150mL﹣100mL=50mL,根据方程式可知n(HCO3﹣)=n(H+);
第四阶段,发生反应Al(OH)3+3H+═Al3++3H2O,de线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为![]() =0.15L=150mL;
=0.15L=150mL;
A.由上述分析可知,原混合溶液中的CO32﹣与AlO﹣2的物质的量之比为0.05mol:0.05mol=1:1,故A正确;
B.a点溶液中,溶质为Na2CO3,由质子守恒可知:c(HCO3﹣)+2c(H2CO3)+c(H+)=c(OH﹣),故B错误;
C.b点碳酸钠和碳酸氢钠的浓度相等,加入了75mL盐酸,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3﹣)>c(CO32﹣),所得溶液中阴离子浓度大小顺序为:c(Cl﹣)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣),故C正确;
D.d→e的过程中铝离子的浓度逐渐增大,铝离子水解促进了水的电离,则该段水的电离程度逐渐增大,故D错误;
故答案为AC。

【题目】摩尔盐在工业上有重要的用途。已知其由一种阴离子,两种阳离子组成的晶体,某学习小组按如下实验测定摩尔盐样品的组成。步骤如下:
①称取3.920g摩尔盐样品配制250mL溶液。
②取少量配制溶液,加入KSCN溶液,无明显现象。
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀。
④定量测定如下:
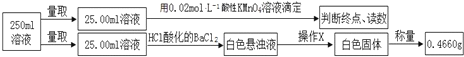
滴定实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
完成下列填空:
(1)步骤①中需要的定量仪器为________________ 、__________________。
(2)步骤②的目的是_____________________________________________________。产生红褐色沉淀的离子方程式_____________________________________。
(3)步骤④中操作X为_________________________________(按操作顺序填写)。
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,_______(填“能”或“不能”),请说明理由__________________________________________________。
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将__________。(选填“ 偏大”、“偏小”或“不变”)。
(6)通过上述实验测定结果,推断摩尔盐化学式为______________________________。