题目内容
生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g) CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。
(1)已知:① CH4(g)+3/2 O2(g) CO(g)+2H2O(g)△Hl;
CO(g)+2H2O(g)△Hl;
② H2(g)+1/2 O2(g) H2O(g) △H2,
H2O(g) △H2,
则CH4(g)+ H2O(g) CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
(2)一定条件下反应CH4(g)+H2O(g) CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB
CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB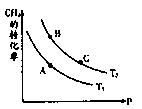
(3)维持温度T2,将0.04 mol CH4和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=____ ,下列现象能说明该反应已经达到平衡状态的是_ ___
a.容器内CH4、H2O、CO、H2的物质的量之比为1:1:1:3
b.容器的密度恒定
c.容器的压强恒定
d.3υ正(CO)=υ逆((H2)
(4)在上述B点平衡基础上,向容器中再通入amol CH4和a mol H2O气体,使之在C点重新达平衡,此时测得CO有0.03mol,则a=____ 。
(1)ΔH1—3ΔH2(2分) (2)> (2分); < (2分)
(3)1.08×10-2mol2?L-2(2分,单位可不作要求);acd(3分) (4)0.035(3分)
解析试题分析:(1)根据已知的热化学方程式以及盖斯定律可知,①-②×3即得到CH4(g)+ H2O(g) CO(g)+3H2(g),所以该反应的反应热△H=ΔH1—3ΔH2。
CO(g)+3H2(g),所以该反应的反应热△H=ΔH1—3ΔH2。
(2)根据图像可知,在压强相同时,温度越高,甲烷的转化率越高。这说明升高温度平衡向正反应方向移动,因此正反应是吸热反应,即△H>0。升高温度平衡向正反应方向移动,因此B点对应的平衡常数大于A点对应的平衡常数。
(3) CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
起始浓度(mol/L) 0.04 0.04 0 0
转化浓度(mol/L) 0.02 0.02 0.02 0.06
平衡浓度(mol/L) 0.02 0.02 0.02 0.06
所以该温度下该反应的平衡常数KB=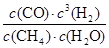 =
=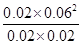 =1.08×10—2mol2?L-2
=1.08×10—2mol2?L-2
在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,根据以上分析可知,平衡时容器内CH4、H2O、CO、H2的物质的量之比为1:1:1:3,所以可以说明反应达到平衡状态,a正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终是不变的,所以b不能说明;该反应是体积减小的可逆反应,所以当压强不再发生变化时,可以说明反应达到平衡状态,即c正确;d中的反应速率方向相反,且满足反应速率之比是相应的化学计量数之比,因此可以说明,d正确,答案选acd。
(4) CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
起始浓度(mol/L) b b 0 0
转化浓度(mol/L) 0.03 0.03 0.03 0.09
平衡浓度(mol/L)b-0.03 b-0.03 0.03 0.09
因为温度不变,平衡常数不变,所以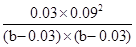 =1.08×10—2,解得b=0.075mol,因此a=0.075mol-0.04mol=0.035mol
=1.08×10—2,解得b=0.075mol,因此a=0.075mol-0.04mol=0.035mol
考点:考查盖斯定律的应用;外界条件对平衡状态的影响;平衡常数的计算和应用等

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案二甲醚是—种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为_______________________________________。
(2)煤的气化过程中产生的有害气体用溶液吸收,生成两种酸式盐,该反应的
化学方程式为__________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);△H=-90.8kJ·mol-1
CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g);△H=-41.3kJ·mol-1
CO2(g)+H2(g);△H=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= ;
CH3OCH3(g)+CO2(g)的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
________________(填字母代号)。
a.高温b.加入催化剂c.减少CO2的浓度d.增加CO的浓度e.分离出二甲醚
(4)已知反应②2CH3OH(g)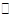 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L) | 0.44 | 0.6 | 0.6 |
 _______
_______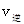 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②若加入CH3OH后,经l0min反应达到平衡,此时c(CH3OH)=__________;该时
间内反应速率v(CH3OH)=__________________。
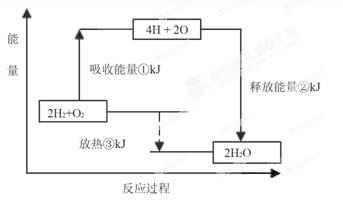
(14分)从能量的变化和反应的快慢等角度研究反应: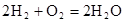 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
| A.使用催化剂 | B.提高氧气的浓度 |
| C.提高反应的温度 | D.降低反应的温度 |
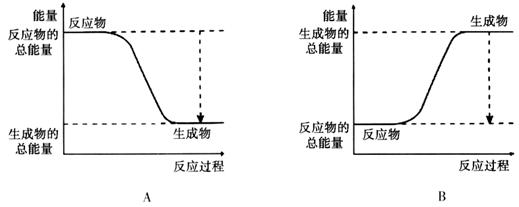
(3)从断键和成键的角度分析上述反应中能量的变化。已知:化学键的键能:
| 化学键 | H—H | O=O | H—O |
键能 | 436 | 496 | 463 |
(4)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为
(5)氢氧燃料电池的总反应方程式为
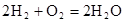 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。  N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
 SO3(g) K1,CO(g)+1/2O2(g)
SO3(g) K1,CO(g)+1/2O2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
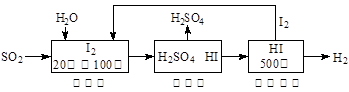
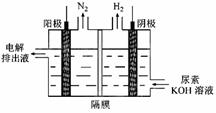
 Ni(OH)2+M
Ni(OH)2+M