题目内容
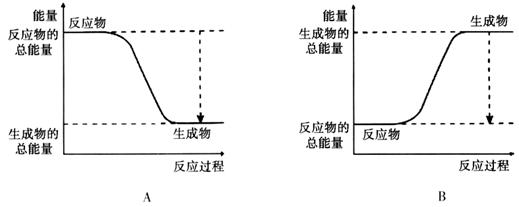
(14分)从能量的变化和反应的快慢等角度研究反应: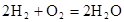 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
| A.使用催化剂 | B.提高氧气的浓度 |
| C.提高反应的温度 | D.降低反应的温度 |
(3)从断键和成键的角度分析上述反应中能量的变化。已知:化学键的键能:
| 化学键 | H—H | O=O | H—O |
键能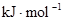 | 436 | 496 | 463 |
(4)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为
(5)氢氧燃料电池的总反应方程式为
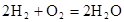 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
(1) ABC (2)A (3)484KJ
(4)2H2 (g)+ O2(g)=2H2O(l) △H=-4QKJ/mol (5)负 氧化 2.24L
解析试题分析:(1)A. 使用催化剂可以大大加快正反应速率。正确。B. 因为氧气是反应物。提高氧气的浓度,及增大反应物的浓度,可以加快化学反应速率。正确。正确。C. 提高反应的温度。可以加快化学反应速率。正确。D. 降低反应的温度,减慢化学反应速率。错误。(2)由于已知该反应为放热反应。则反应物的能量高于生成物的能量,在发生反应时多余的能量释放出来。图像应该为A。(3)断裂化学键吸收能量,形成化学键释放能量,反应过程中的能量变化就是二者的差值,所以2molH2在氧气中燃烧生成气态水放出的热量是2mol×436kJ/mol+1mol×496 kJ/mol-4mol×463 kJ/mol=484KJ.即氧气中燃烧生成气态水的热反应方程式为2H2 (g)+ O2(g)=2H2O(g)。ΔH=-484KJ/mol. (4)因为1克氢气完全燃烧生成液态水放出QKJ的热量,所以氢气燃烧生成液态水的热化学反应方程式为2H2 (g)+ O2(g)=2H2O(l) △H=-4QKJ/mol。(5)在氢氧燃料电池中通入氢气的电极为负极,负极发生氧化反应,n(e-)=0.2mol。则n(H2)=0.1mol. 在标准状况下消耗H2的体积是V=0.1mol×22.4L/mol=2.24L.
考点:考查影响化学反应速率的因素、反应热与键能、物质的状态及多少、原电池反应原理的知识。

氢气是一种清洁、高效的新型能源。
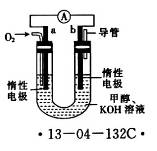
I.用甲烷制取氢气的反应分为两步,其能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
II.在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应。测得CO2的浓度随时间变化的图像如图: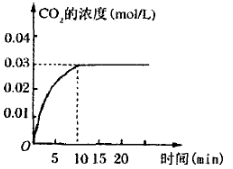
(2)在该温度下,从反应开始至达到平衡时,CO的平均反应速率为 ;
(3)该温度下,此反应的化学平衡常数为(可以用分数表示) ;
(4)下列改变中,能使平衡向正反应方向移动的是 。
| A.升高温度 | B.增大压强 |
| C.增大H2O(g)的浓度 | D.减少CO2(g)的浓度 |
(14分)用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是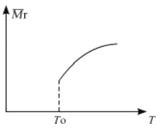
| A.该反应在任何温度下可自发进行 |
| B.若混合气体的总质量不变,表明上述反应己达到平衡状态 |
| C.其他条件不变,增大Si3N4的物质的量,平衡向左移动 |
| D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低 |

假设温度为T1时向该反应容器中同时加入。(SiC14) =0.3 mol/L,c(H2) =0.3 mol/L,,c(N2) =
x mol/L, c (HCl) =0.3 mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值
范围为___
(4)该反应的原子利用率为____
(5)工业上制备SiCl4的反应过程如下:
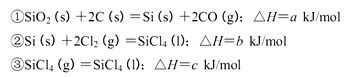
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiC14和一氧化碳的热化学方程式_____
合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 甲 | 乙 | 丙 | ||
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 | ||
| 达到平衡的时间/min | | 5 | 8 | ||
| 平衡时N2的浓度/mol·L-1 | c1 | 1.5 | | ||
| NH3的体积分数 | ω1 | | ω3 | ||
| 混合气体密度/g·L-1 | ρ1 | ρ2 | |
(1)容器乙中反应从开始到达平衡的反应速率为v(H2)=___________。
(2)在该温度下甲容器中反应的平衡常数K= (用含c1的代数式表示)。
(3)分析上表数据,下列关系正确的是________(填序号):
a.2c1 > 1.5 b.2ρ1 = ρ2 c.ω3 = ω1
II.工业上用氨气合成尿素(H2NCONH2)的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)
 H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1第二步:H2NCOONH4(l)
 H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2 (4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示:
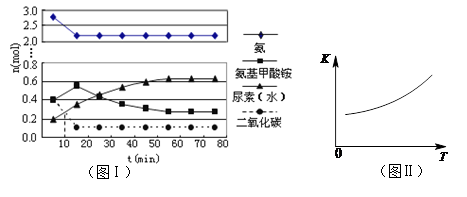
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②第二步反应的平衡常数K随温度T的变化如右上图II所示,则△H2 0;③若第一步反应升温时氨气浓度增大,请在图II中画出第一步反应K1随温度T变化曲线,并作出必要的标注。
(5)氨和尿素溶液都可以吸收硝工业尾气中的NO、NO2,将其转化为N2。
①尿素与NO、NO2三者等物质的量反应为:CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
该反应中的氧化剂为 (写化学式)。
②已知:N2(g)+O2(g)= 2NO(g) △H ="a" kJ·mol-1
N2(g)+3H2(g)= 2NH3(g) △H2="bkJ·" kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H=" c" kJ·mol-1
则4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) △H= 。
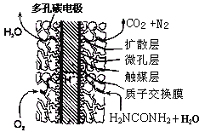
③尿素燃料电池结构如下图所示。其工作时负极电极反应式可表示为 。
80℃时,2L密闭容器中充入0.40molN2O4,发生反应
N2O4 2NO2
2NO2 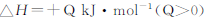 ,获得如下数据:
,获得如下数据: 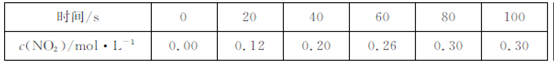 下列判断正确的是
下列判断正确的是
| A.升高温度该反应的平衡常数K减小 |
B.20~40s内,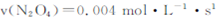 |
| C.反应达平衡时,吸收的热量为0.30QkJ |
| D.100s时再通入0.40molN2O4,达新平衡时N2O4的转化率增大 |
 CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。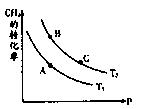

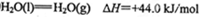
 MnO4-+
MnO4-+ 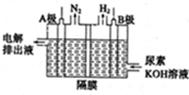
 SO3(g) +NO(g),
SO3(g) +NO(g),