题目内容
5.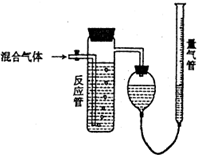 测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )| A. | 偏高 | B. | 偏低 | C. | 无影响 | D. | 无法确定 |
分析 反应管内溶液蓝色消失时,SO2与反应管内所含的I2恰好反应,若没及时停止通气,则未反应的SO2气体也排水到量气管,使N2、O2体积增加,测得SO2的含量降低;
解答 解:根据反应:SO2+I2+2H2O═H2SO4+2HI可求出吸收的SO2的体积:V(SO2)=Vm×n(I2),SO2的体积百分含量φ(SO2)=$\frac{V(S{O}_{2})}{V(混合气体)}$式中V(SO2)的量是由n(I2)的物质的量决定的,而“没有及时停止通气”就会使得V(混合气体)增大,则φ(SO2)偏低,
故答案为:偏低;
点评 本题考查的是二氧化硫的性质、含量的测定,误差分析方法,为高频考点,侧重于学生的分析问题能力的考查,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.在反应A+2HCl═MgCl2+2B中A可能是下列物质中的( )
| A. | Mg | B. | MgO | C. | Mg(OH)2 | D. | MgCO3 |
16.摩托罗拉公司研发了一种以甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用一个月才充一次电,其电池反应原理为:2CH3OH+3X+4NaOH═2Na2CO3+6H2O,其中X的化学式是( )
| A. | O2 | B. | CO | C. | CO2 | D. | H2 |
13.有一种石灰石样品,其中含有的杂质是二氧化硅(它是一种不溶于水,也不与盐酸反应,耐高温的固体物质),某同学想测定该样品的纯度,他取用2g这种石灰石样品,把20g稀盐酸分四次加入,充分反应后剩余固体的质量见下表所示:
(1)2g石灰石样品中的杂质质量是;
(2)石灰石样品的纯度为;
(3)100Kg这种纯度的石灰石充分煅烧后,可得到固体多少克?
| 稀盐酸的质量 | 剩余固体的质量 |
| 第1次加入5g | 1.315g |
| 第2次加入5g | 0.63g |
| 第3次加入5g | 0.3g |
| 第4次加入5g | 0.3g |
(2)石灰石样品的纯度为;
(3)100Kg这种纯度的石灰石充分煅烧后,可得到固体多少克?
20.25℃时,100mL 0.1mol/L的三种盐溶液NaX、NaY、NaZ,pH分别为7、8、9.下列说法正确的是( )
| A. | 相关微粒浓度关系:c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | |
| B. | 三种溶液所含阴阳离子的总数依次减小 | |
| C. | 三种溶液均加水稀释到1000mL,pH分别变为8、9、10 | |
| D. | HX、HY、HZ的酸性依次增强,电离平衡常数依次减小 |
10.下列实验操作正确的是( )
| A. | 为防止药品滴在桌面上,胶头滴管可伸入试管内部滴加液体 | |
| B. | 用量筒取13.37mL的稀硫酸 | |
| C. | 给试管内液体加热时,液体体积不超过试管容积的1/4 | |
| D. | 向酒精灯内添加酒精时,不能超过酒精灯容积的2/3 |
15.下列离子方程式正确的是( )
| A. | 向NaOH溶液中通入少量的SO2:SO2+OH-═HSO3- | |
| B. | 向氯水中通入少量的SO2:Cl2+SO2+2H2O═4H++2Cl-+SO42- | |
| C. | 将SO2通入到饱和的NaHCO3溶液中:2H++CO32-═H2O+CO2↑ | |
| D. | 将SO2通入到BaCl2溶液中:SO2+H2O+Ba2+═BaSO3↓+2H+ |