题目内容
20.25℃时,100mL 0.1mol/L的三种盐溶液NaX、NaY、NaZ,pH分别为7、8、9.下列说法正确的是( )| A. | 相关微粒浓度关系:c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | |
| B. | 三种溶液所含阴阳离子的总数依次减小 | |
| C. | 三种溶液均加水稀释到1000mL,pH分别变为8、9、10 | |
| D. | HX、HY、HZ的酸性依次增强,电离平衡常数依次减小 |
分析 常温下,0.1mol/L的三种盐溶液NaX.NaY.NaZ的PH分别为7、8、9,对于弱酸,其酸性越弱,对应的盐水解程度越大,说明HX为强酸,HY、HZ为弱酸,且酸性HY>HZ,由此分析解答.
解答 解:A、NaX电离后不水解,X-的物质的量浓度c(X-)=0.1mol/L,NaY、NaZ电离后都部分水解,根据物料守恒可知:c(Y-)+c(HY)=0.1mol/L;c(Z-)+c(HZ)=0.1mol/L,所以c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ),故A正确;
B、根据电荷守恒,三种溶液所含阴阳离子的总数都是2[n(Na+)+n(H+)]×NA,而钠离子的物质的量相等,而pH分别为7、8、9,氢离子的浓度依次减小,所以体积一定的溶液中氢离子的物质的量逐渐减小,所以离子浓度越小,所以所含阴阳离子的总数依次减小,故B正确;
C、三种溶液均加水稀释到1000mL后,NaX的PH等于7,而对NaY、NaZ溶液的水解起促进作用,故C错误;
D、电离平衡常数对弱电解质HY、HZ,而HX完全电离,无电离平衡常数,故D错误;
故选:AB.
点评 本题考查盐类的水解,题目难度不大,注意酸根离子水解程度越大,对应的酸越弱.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
14.下列叙述正确的是( )
| A. | 同质量的H2和Cl2相比,H2的分子数少 | |
| B. | 0.5 mol 氢的质量是0.5g | |
| C. | H2SO4的摩尔质量等于98g | |
| D. | 44g CO2与28g CO所含的分子数均为NA |
11.下列各种说法中,不正确的是( )
| A. | 物质的量浓度均为0.1mol•L-1的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液、水的电离程度的大小顺序是①>②>③ | |
| B. | 将100mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 | |
| C. | 向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中(NH4+)/c (NH3•H2O)先增大再减小 | |
| D. | 等物质的量的二元弱酸H2X与其钾盐K2X-的混合液中:c(K+)=c(H2X)+c(HX-)+c(X2-) |
15. 中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
1)煤气化包含一系列化学反应,已知:
C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1,
C(s)+CO2(g)=2CO(g))△H2=+172kJ•mol-1;
则反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H3=-40.7kJ•mol-1;
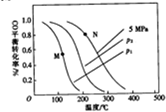
(2)以投料比$\frac{n({H}_{2})}{n(CO)}$=2制取甲醇,发生反应,CO(g)+2H2(g)=CH3OH(g)△H,温度、压强与CO的平衡转化率关系如下图所示:
①△H<0,P1<P2,(填“>”或“<”)
②比较图中M、N两点对应温度下反应的平衡常数大小:K(M)>(填“>”或“<”或“=”)K(N)
③若提高起始时的投料比[$\frac{n({H}_{2})}{n(CO)}$],则CO的平衡转化率将增大(填”增大““减小”或“不变”).
④实际工业生产中大多采用的条件为5MPa和230~270℃,由下表可知其优点是低压法所需设备要求低,副反应少,催化剂易再生.
 中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)1)煤气化包含一系列化学反应,已知:
C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1,
C(s)+CO2(g)=2CO(g))△H2=+172kJ•mol-1;
则反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H3=-40.7kJ•mol-1;
(2)以投料比$\frac{n({H}_{2})}{n(CO)}$=2制取甲醇,发生反应,CO(g)+2H2(g)=CH3OH(g)△H,温度、压强与CO的平衡转化率关系如下图所示:
①△H<0,P1<P2,(填“>”或“<”)
②比较图中M、N两点对应温度下反应的平衡常数大小:K(M)>(填“>”或“<”或“=”)K(N)
③若提高起始时的投料比[$\frac{n({H}_{2})}{n(CO)}$],则CO的平衡转化率将增大(填”增大““减小”或“不变”).
④实际工业生产中大多采用的条件为5MPa和230~270℃,由下表可知其优点是低压法所需设备要求低,副反应少,催化剂易再生.
| 方法 | 催化剂 | 条件 | 备注 | 特点 | |
| 压力/MPa | 温度/℃ | ||||
| 高压法 | ZnO-Cr2O3 二元催化剂 | 25-30 | 380-400 | 1924年工业化 | (1)催化剂不易中毒,再生困难 (2)副反应多 |
| 低压法 | CuO-ZnO-Al2O3 三元催化剂 | 5 | 230-270 | 1966年工业化 | (1)催化剂易中毒,再生容易 (2)副反应少 |
5.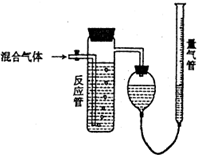 测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )
 测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )| A. | 偏高 | B. | 偏低 | C. | 无影响 | D. | 无法确定 |
12.小强用托盘天平称5.0克食盐,当指针不在分度盘中央而偏右时,就开始称量.称量后天平达到平衡时(指针在分度盘中央),则实际称量的食盐的质量( )
| A. | 等于5.0克 | B. | 小于5.0克 | C. | 大于5.0克 | D. | 无法判断 |
9.下列有关化学实验的叙述正确的是( )
| A. | 为了增强高锰酸钾溶液的氧化能力,用稀盐酸将高锰酸钾溶液进行酸化 | |
| B. | 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 | |
| C. | 用稀盐酸洗涤盛放过石灰水的试剂瓶 | |
| D. | 欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4•7H2O溶解在90 g水中 |
10.在一定条件下,还原性顺序为Cl-<Br-<Fe2+<I-<SO2<H2S,由此判断下列反应不能发生的是( )
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | B. | 2Fe3++H2S═2Fe2++S↓+2H+ | ||
| C. | I2+SO2+2H2O═2I-+SO42-+4H+ | D. | 2Br-+SO42-+4H+═Br2+SO2↑+2H2O |