题目内容
【题目】硫是人类认识最早的元素之一,含硫物质在现代生产和生活中发挥着重要作用。
(l)我国化学家姜雪峰因其在绿色有机硫化学领域的杰出贡献被遴选为“全球青年化学家元素周期表硫元素代表”。
①硫元素在元素周期表中的位置是 ____。
②乙硫醇(CH3CH2SH)是一种含硫有机物,其分子中S-H的极性小于CH3CH2OH分子中O-H的极性,请从原子结构角度解释其原因:____。
(2)自然界的硫循环过程如下图所示。
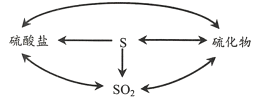
①上图所涉及的含硫物质中,能使品红溶液褪色的是____。
②降解石油(主要成分为CxHy)的过程中,在细菌催化作用下,石油与硫酸盐反应转化为碳酸氢盐,硫酸盐做____(填“氧化剂”或“还原剂”)。
③煤炭中的硫化物主要为FeS2(S为-1价)。在潮湿的环境中,FeS2可在氧化亚铁硫杆菌(T.f)的作用下被空气氧化为Fe2(SO4)3,该反应的化学方程式为____。
【答案】第三周期,第ⅥA族 氧原子与硫原子最外层电子数相同,电子层数S>O,原子半径S>O,得电子能力S<O,对共用电子对的吸引作用S<O,因此,S-H的极性小于O-H的极性。 SO2(或二氧化硫) 氧化剂 4FeS2+15O2+2H2O![]() 2Fe2(SO4)3+2H2SO4
2Fe2(SO4)3+2H2SO4
【解析】
(1)①硫元素在元素周期表中的位置是第三周期,第ⅥA族;
②氧原子与硫原子最外层电子数相同,电子层数S>O,原子半径S>O,得电子能力S<O,对共用电子对的吸引作用S<O,因此,S-H的极性小于O-H的极性。所以乙硫醇(CH3CH2SH)中S-H的极性小于CH3CH2OH分子中O-H的极性。
(2)①SO2具有漂白性使品红溶液褪色的是SO2
②石油与硫酸盐反应转化为硫化物化合价从+6降到-2,所以硫酸盐做氧化剂
③FeS2可在氧化亚铁硫杆菌(T.f)的作用下被空气氧化为Fe2(SO4)3的化学方程式为
4FeS2+15O2+2H2O![]() 2Fe2(SO4)3+2H2SO4
2Fe2(SO4)3+2H2SO4

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案