题目内容
【题目】欲用98%的浓硫酸(密度为1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500毫升.
(1)选用的主要仪器除了烧杯、玻璃棒、胶头滴管外还有:_______________(写两个)
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线
D.稀释浓H2SO4
E.将溶液转入容量瓶
其操作正确的顺序依次为____________________________。
(3)简要回答下列问题:
①98%的浓硫酸的物质的量浓度为_____________mol·L-1
②配制成浓度为0.5mol·L-1的稀硫酸500毫升.所需98%的浓硫酸的体积为____________mL;(保留小数点后一位)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是_____;
④定容时必须使溶液凹液面与刻度线相切,若仰视刻度则使浓度___________。(“偏高”、“偏低”、“无影响”)
【答案】量筒、500ml容量瓶 ADECB 18.4 13.6 防止液体飞溅 偏低
【解析】
(1)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用量筒量取,在烧杯中溶解,并用玻璃棒搅拌,加速溶解。冷却后,用玻璃棒引流转移到500mL容量瓶中;洗涤烧杯、玻璃棒23次,并将洗涤液移入容量瓶中;加水至液面距离刻度线12cm时,改用胶头滴管滴加,最后定容颠倒摇匀。所以所需的玻璃仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管。根据提供的仪器可知,还需仪器有量筒、500mL容量瓶;
(2)配制500mL0.5mol/L的稀硫酸溶液的步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以正确的配制顺序为ADECB;
(3)①98%的浓硫酸(ρ=1.84gcm3)的物质的量浓度为:![]() ;
;
②稀释前后溶液含溶质的物质的量不变,设需要浓硫酸体积为V,则V×18.4mol/L=0.5mol/L×500mL,解得:V=13.6ml;
③浓硫酸稀释放热,溶液的温度升高,用玻璃棒不断搅拌的目的是防止液体局部过热造成飞溅;
④定容时仰视刻度线,溶液的液面在刻度线以上,导致溶液体积偏大,![]() ,浓度偏低。
,浓度偏低。

【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
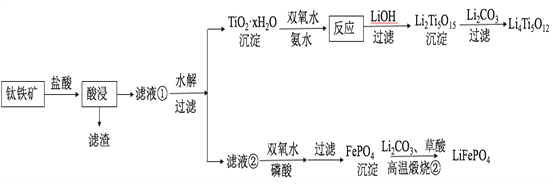
回答下列问题:
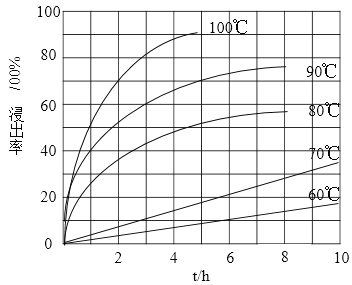
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。