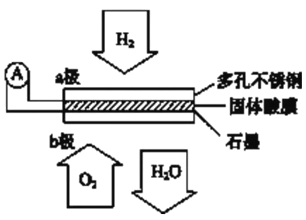
题目内容
【题目】下列说法正确的是
A. 向50mL 1mol·L-1的盐酸中加入烧碱,水的KW不变
B. NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用
C. 有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+)
D. 常温0.1mol·L-1HA溶液中c(OH-)/ c(H+)=10-8,则0.01mol·L-1 HA溶液中c(H+)=1×10-4mol·L-1
【答案】B
【解析】
A.Kw只受温度的影响,盐酸中加入烧碱发生酸碱中和反应,放出热量,使体系温度升高,Kw值增大,故A错误;
B.铵根离子水解方程式:NH4++H2O![]() NH3H2O+H+加入一水合氨,一水合氨浓度增大,平衡向逆向移动,抑制铵根离子的水解;一水合氨的电离方程式:NH3H2O
NH3H2O+H+加入一水合氨,一水合氨浓度增大,平衡向逆向移动,抑制铵根离子的水解;一水合氨的电离方程式:NH3H2O![]() NH4++OH-,加入氯化铵溶液,铵根离子浓度增大,平衡向逆向移动,抑制了一水合氨的电离,故B正确;
NH4++OH-,加入氯化铵溶液,铵根离子浓度增大,平衡向逆向移动,抑制了一水合氨的电离,故B正确;
C.因为酸性HX>HY,所以水解能力NaX<NaY,体积和浓度相同的NaX和NaY溶液混合后离子浓度关系为:c(X-)>c(Y-)>c(OH-)>c(H+),故C错误;
D.0.1molL-1 HA溶液中,c(OH-)/c(H+)=1×10-8,c(OH-)×c(H+)=1×10-14,所以c(H+)=10-3molL-1,该酸为弱酸,加水稀释时弱酸的电离程度增大,所以0.01molL-1 HA溶液中c(H+)>1×10-4molL-1,故D错误;
故选B。

练习册系列答案
相关题目